3 Energía libre de Gibbs
 |
| Imagen 7 Reddi, Dominio público |
Como has visto, los sistemas tienden a pasar espontáneamente a estados de mínima energía y de máxima entropía.
Para tener en cuenta la influencia de ambas magnitudes, H y S, se define una nueva función termodinámica, la energía libre de Gibbs (o entalpía libre), G, definida como G = H - TS .
También es una función de estado y sólo depende de los estados inicial y final del sistema, pero no de la forma de paso entre ellos. Cuando un sistema experimenta un cambio a temperatura y presión constantes, se puede determinar la espontaneidad del proceso evaluando el cambio de G sin preocuparse del cambio de esa magnitud para el entorno.
La variación de energía libre de un sistema, a presión y temperatura constantes, viene dada por:
ΔG = ΔH - TΔS
Entalpías libres de formación
La aditividad de las energías libres de Gibbs se cumple igual que para las entalpías (ambas son funciones de estado) y permite realizar cálculos de ΔG análogos a los que has visto para ΔH. Es decir, para cada sustancia se define la entalpía libre normal de formación ΔGºf (análoga a ΔHºf).
El valor de ΔGºf es una medida de la estabilidad de un compuesto con respecto a sus elementos. Cuando ΔGºf es negativo, el compuesto es estable, tanto más cuanto más negativo sea el valor de ΔGºf.
Por tanto, en una reacción química también se cumple que:
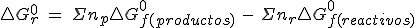
Debes trabajar exactamente igual que con la entalpía para calcular entalpías libres de formación.