2.1 Segundo y tercer principio de la Termodinámica
 |
| Imagen 6 Reh, Uso libre |
Segundo principio de la Termodinámica
La entropía está relacionada con los otros dos principios de la Termodinámica. Como en general los estados desordenados son más probables que los ordenados, un sistema aislado que no esté en equilibrio evoluciona espontáneamente hacia estados de máximo desorden, que son los más probables.
Se puede enunciar el segundo principio diciendo que cualquier proceso que ocurre espontáneamente produce un aumento de entropía del Universo (ΔSU ≥ 0). En algunos casos puede producirse una disminución de entropía en el sistema, pero la del entorno aumentará al menos lo mismo.
Tercer principio de la Termodinámica
Está relacionado con los valores que toma la entropía. A diferencia de la energía interna o de la entalpía, es posible conocer el valor de la entropía de una sustancia a una temperatura y presión determinadas, de manera que se tabulan las entropías molares estándar (a la presión de 1 atm y a la temperatura de 25 ºC).
El tercer principio de la Termodinámica establece que la entropía de un elemento puro en su forma condensada estable, formando una red sólida cristalina sin defectos, es cero cuando la temperatura tiende a cero.
Según este principio, todas las entropías molares estándar son positivas, proporcionando un origen de entropías. Pero como no se puede alcanzar un estado de orden absoluto, con entropía cero, otra forma de plantearlo es decir que no se puede llegar al cero absoluto de temperaturas.
Como ocurre con la entalpía estándar de reacción, la variación de la entropía en una reacción química puede determinarse a partir de las entropías molares estándar de reactivos y productos:
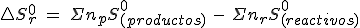
¿Cuánto vale el incremento de entropía estándar del proceso H2O(g) → H2O(l) a 25ºC?
|
La entropía no cambia en el proceso.
| |
|
-118.8 JK-1mol-1
| |
|
118.8 JK-1mol-1
| |
|
-237.6 JK-1mol-1
|
¿Todo tiene que estar ordenado?
Te va a resultar fácil ver la influencia del segundo principio a tu alrededor, porque los cambios en la naturaleza actúan en la dirección del desorden: los objetos se descolocan, las cosas se desordenan, la ropa se ensucia. Y para tener las cosas a punto es preciso estar constantemente arreglando y limpiando el polvo y ordenando. ¡Al fin y al cabo, ser desordenado es seguir la tendencia de la Naturaleza!
Clausius y la entropía
El término entropía lo introdujo el físico alemán Clausius para representar el grado de uniformidad con que está distribuida la energía, sea de la clase que sea. Cuanto más uniforme sea la distribución, mayor es la entropía. Cuando la energía está distribuida de manera perfectamente uniforme, la entropía es máxima para el sistema en cuestión.
Clausius observó que cualquier diferencia de energía dentro de un sistema tiende siempre a igualarse por sí sola. Clausius afirmó por tanto que en la naturaleza era regla general que las diferencias en las concentraciones de energía tienden a igualarse.
En los vídeos siguientes verás algunas concepciones sobre la entropía que seguro que te llaman la atención.
|
|
|
| Video 2 Fernandogonzalez28, Uso libre |
Vídeo 3 Fernandogonzalez28, Uso libre |