4. Aplicaciones
El estudio del carácter térmico y de la espontaneidad de los procesos tiene muchas aplicaciones en la vida diaria. Ahora vas a ver algunas de ellas.
 |
| Imagen 9 Cabrera, Creative commons |
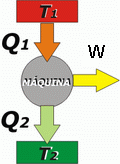
Máquinas térmicas
Son aparatos que mediante el intercambio de energía entre dos focos permiten la realización de trabajo. En un motor se extrae energía en forma de calor del foco caliente y se cede al frío; la diferencia entre el calor extraído y el cedido es el trabajo realizado, y el porcentaje de trabajo realizado frente al calor extraído se llama rendimiento del motor. Pero si se realiza trabajo para extraer energía en forma de calor desde el foco frío para cederlo al caliente (que es un proceso no espontáneo), es una máquina frigorífica.
En la imagen se extraen Q1 unidades de energía del foco caliente, a T1, y se ceden Q2 unidades al foco frío, a T2. El trabajo realizado es la diferencia entre ambos calores (W=Q1-Q2).
Procesos biológicos
La fotosíntesis es el proceso natural en el que las plantas sintetizan glucosa a partir del CO2 y del vapor de agua que hay en el aire:
6 CO2(g) + 6 H2O(g) → C6H12O6(s) + 6 O2(g)
Fíjate en que además se libera oxígeno a partir del dióxido de carbono, por lo que las plantas regulan la cantidad de ambos gases en la atmósfera.
Se trata de un proceso endotérmico, en el que se necesitan 1875 kJ por mol de glucosa. Además, la entropía disminuye (a partir de 12 moles de gas se obtienen 6 de gas y uno de sólido), por lo que el proceso no es espontáneo, y es la energía solar la que permite la realización de este proceso.
Reservas de combustibles
Los procesos de combustión son muy espontáneos, pero no se observan: un trozo de carbón no se quema aun estando en contacto con el oxígeno del aire. ¡Pero es un proceso muy exotérmico y con un gran aumento de entropía!
¿Por qué no se quema la madera? En realidad se está quemando, pero a velocidad tan pequeña que resulta inapreciable: para que los reactivos se transformen en productos deben superar una barrera de energía o energía de activación, lo que necesita el aporte de un poco de energía: llama, chispa eléctrica, frotamiento. Una muy pequeña parte de la energía desprendida sirve para automantener el proceso y el resto se libera en forma de calor.
La existencia de barreras de energía en los procesos de combustión es absolutamente fundamental, ya que permite la
existencia de reservas energéticas, al no quemarse los combustibles hasta que se provoca el inicio de la reacción.
Es decir, una cosa es que un proceso sea espontáneo y otra muy distinta que sea rápido. En el tema siguiente estudiarás la velocidad de las reacciones y profundizarás en las barreras de energía.
La degradación de la energía
El significado energético de la entropía es muy importante, ya que es una medida de la cantidad de energía que no se puede extraer de un sistema: al aumentar la entropía, la energía está menos concentrada (o más distribuida), por lo que resulta más difícil extraerla para utilizarla.
La entropía determina la proporción de energía que no puede liberarse. Éste es el gran problema de la sociedad actual, ya que las fuentes de energía se van agotando. Pero ¿por qué es un problema si la energía total del Universo permanece constante? Porque cada vez aumentando la proporción de energía que no resulta útil, ya que no se puede liberar. Es decir, la energía se va degradando a formas de mayor entropía.
Un trozo de carbón se quema, y la energía de los productos es
la misma que la que tenían el trozo de carbón y el oxígeno que han reaccionado, pero es mucho más difícil
extraerla de ellos para volverla a utilizar.