2. La entropía
Ya has visto que los sistemas tienen a evolucionar espontáneamente en el sentido en que haya una disminución de energía química, con lo que la reacción será exotérmica (ΔH<0). Pero como hay procesos endotérmicos que son espontáneos, debe haber otro factor que sea relevante, que es la entropía (S).
De esta forma, un sistema aislado evoluciona en el sentido en el que se produzca un aumento de entropía ΔS>0, y alcanza la situación de equilibrio cuando su entropía es máxima.
Las entropías se miden en condiciones estándar, y se dispone de los
datos por mol de sustancia (entropías molares). Sus unidades son: J mol-1K-1.
Interpretación de la entropía
La entropía está relacionada con el grado de desconocimiento que se tiene de las propiedades de un sistema. En Química se cuantifica teniendo en cuenta el estado físico y la cantidad de sustancia presente.
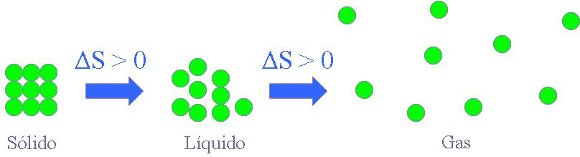
De forma muy aproximada y general, se puede decir que, en igualdad de condiciones, las entropías de los gases son mayores que las de los líquidos y éstas a su vez mayores que las de los sólidos. Es evidente que es más difícil conocer las propiedades de cada una de las partículas de un gas, que se mueven de forma desordenada por todo el recipiente que las contiene, que de un sólido, cuyas partículas están mucho más ordenadas.
 |
| Imagen 3 Elaboración propia |
También es mayor la entropía cuanto mayor sea la cantidad de sustancia, ya que es más difícil conocer las propiedades de un conjunto de partículas cuanto mayor sea su número. De esta forma, en las reacciones químicas la ΔS del sistema dependerá en general de la variación
de la cantidad de sustancia de gas: si aumenta la cantidad de sustancia de gas al producirse la reacción, aumenta ΔS >0, disminuyendo en caso contrario.
Factores de los que depende la entropía
La entropía aumenta:
- En la secuencia sólido - líquido -gas.
- En los procesos de disolución de sólidos.
- Al aumentar la cantidad de sustancia.
- Al aumentar la temperatura.
 |
| Imagen 4 Aegon, Creative commons |
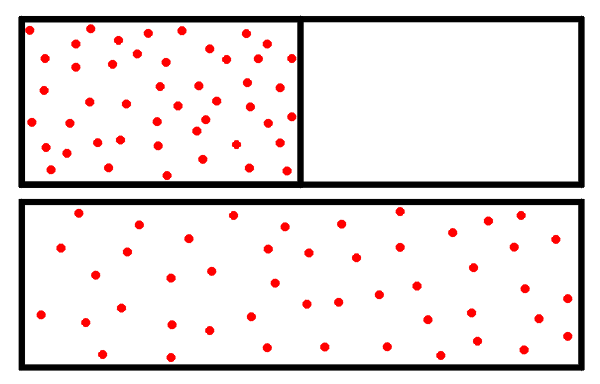
¿Dónde es mayor la entropía, antes o después de la expansión del gas?
.svg.png) |
| Imagen 5 Cepheiden, Dominio público |
¿Dónde es mayor la entropía, antes o después de la mezcla de los dos gases? Fíjate en que la trayectoria de una partícula del gas que inicialmente estaba a la izquierda ahora puede estar en todo el recipiente.