3.1 Criterio de espontaneidad
¿Cómo puedes saber si un sistema evolucionará espontáneamente o no lo hará? Al pasar a un estado de menor entalpía, se desprende energía en forma de calor en el proceso, y ΔH es negativo. Por otro lado, cuando aumenta el desorden, aumenta la entropía, con lo que ΔS es positivo y -TΔS será negativo. Por tanto ΔG, que es ΔH - TΔS, será negativo.
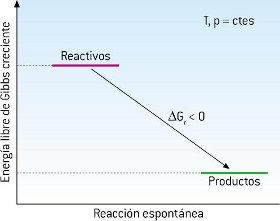
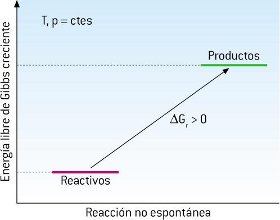
En resumen, se puede tomar como criterio de espontaneidad que para que un proceso sea espontáneo, su ΔG ha de ser negativo, ΔG<0, es decir, la energía libre del sistema debe disminuir.
Evidentemente, cuando ΔG sea positivo el proceso no puede producirse de forma espontánea, y lo que ocurrirá espontáneamente es el proceso inverso.
En el caso de que ΔG = 0 el sistema ha alcanzado un estado de equilibrio, y no evoluciona (sus propiedades no cambian a lo largo del tiempo).
 |
 |
| Imagen 8 Elaboración propia | |
Observa la tabla siguiente y verás que se pueden dar cuatro casos diferentes, según sean positivos o negativos los valores de ΔH y ΔS, de manera que en unos casos ΔG es positivo y en otros negativo.
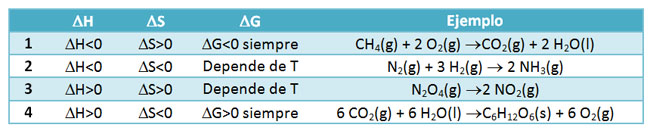
El caso 1 siempre es espontáneo, ya que los factores energético y entrópico son favorables (disminuye la energía química y aumenta el desorden). Por el contrario, el caso 4 no es espontáneo nunca, ya que los dos factores son contrarios. Sin embargo, en los casos 2 y 3 uno de los factores es favorable y el otro contrario, por lo que el hecho de que el proceso sea espontáneo o no depende del valor de la temperatura, como verás más adelante.
ΔG y grado de reacción
Si una reacción tiene un valor de ΔG de -10000 kJ, muy negativo, parece obvio afirmar que será espontánea. Y si otra tiene un ΔG de 8000 kJ, valor muy positivo, será lógico pensar que no será espontánea, y que, en consecuencia, no se producirá.
Pero ¿y si ΔG es 0,1 kJ? ¿ó -0,1 kJ? ¿En el primer caso no se realizará y en el segundo sí, cuando la diferencia entre ambos valores es de solamente 0,2 kJ?
En realidad, que un proceso sea espontáneo ó no espontáneo no quiere decir que haya o no haya reacción. Siendo α el grado de reacción, (el porcentaje de reactivos que reacciona), cuanto más negativo sea ΔG de una reacción dada, mayor será el grado de reacción. Es decir, si un proceso no es espontáneo no significa que no se produzca, sino que el grado de reacción es pequeño.
Criterio de espontaneidad
Para que un proceso sea espontáneo, ΔG<0, y cuanto menor sea ΔG, más tendencia tendrá la reacción a producirse.
| Vídeo 4 Burkottawa, Uso libre |
Una reacción química endotérmica
En el vídeo puedes ver la realización de una reacción química endotérmica que es espontánea. Se trata de dos sustancias sólidas que reaccionan produciendo una bajada de temperatura tan apreciable que congela el agua que mojaba el exterior del recipiente.
Fíjate en que el trozo de madera queda pegado al congelarse la capa de agua que había entre él y el recipiente de reacción.
Las explicaciones se dan en inglés, pero la reacción se escribe en la pizarra y resulta sencillo seguir el proceso.