3. Hibridación de orbitales
La estructura del átomo de carbono es C:1s2 2s2 2px 2py. Como no tiene más que dos electrones desapareados, solamente podrá formar dos enlaces según la teoría de enlace de valencia. ¡Pero es que en los millones de compuestos de carbono que se conocen, -con excepción del CO- forma cuatro enlaces!
|
| Imagen 15 Elaboración propia |
¿Qué necesita el átomo de carbono para formar cuatro enlaces? Nada más que tener cuatro electrones desapareados. La forma más sencilla de lograrlo es hacer que un electrón del orbital 2s pase al orbital vacío 2pz. Es decir, se alcanza un estado excitado del carbono, ya que pasa un electrón de un estado de menor energía (orbital 2s) a otro de mayor energía (orbital 2pz). Sin embargo, por el hecho de producirse esta promoción electrónica el carbono forma cuatro enlaces en lugar de dos, y como al formar enlaces se desprende energía, en conjunto el balance energético es favorable (debe serlo, ya que al formarse compuestos del carbono a partir de sus elementos se observa desprendimiento de energía).
C*: 1s2 2s 2px 2py 2pz
Si utilizases los cuatro orbitales anteriores para formar enlaces al superponerse con los orbitales 1s de cuatro átomos de hidrógeno, habría tres enlaces iguales, originados por los tres orbitales p, y uno diferente, producido por el orbital s.
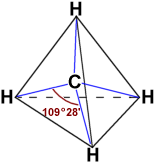
Pero si te fijas en la estructura de la molécula de metano, verás que tiene cuatro enlaces C-H exactamente iguales, dirigidos hacia los vértices de un tetraedro formando un ángulo de unos 109.5º.
Es decir, con los argumentos que tienes hasta ahora, no es posible explicar correctamente las características experimentales del enlace en esta molécula.
Hay casos como BeCl2 y BF3 en los que, como en el CH4, tampoco se puede explicar la existencia de la molécula, mientras que en casos como el H2O y el NH3 lo que no es posible justificar correctamente es el ángulo de enlace.