4. Polaridad de los enlaces y de las moléculas
Cuando los dos átomos unidos mediante enlace covalente tienen electronegatividad diferente, la nube electrónica está más cerca del más electronegativo. El enlace se llama polar, y es un tipo particular de enlace covalente.
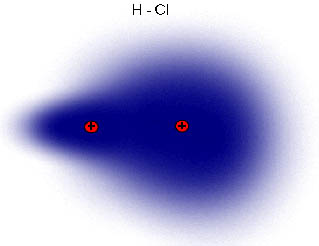
Observa en la imagen lo que sucede con el cloro y el hidrógeno: los electrones están más cerca del cloro, más electronegativo, que del hidrógeno. También se suele indicar una cierta densidad de carga negativa sobre el cloro y positiva sobre el hidrógeno, donde delta (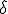 , que representa la densidad de carga) es menor que la unidad, ya que en ese caso se habrían formado dos iones.
, que representa la densidad de carga) es menor que la unidad, ya que en ese caso se habrían formado dos iones.
Esta distribución de dos cargas de la misma magnitud y signo contrario se llama dipolo, y su efecto se mide por el momento dipolar, magnitud vectorial cuyo módulo es el valor de las cargas por la distancia que las separa. Al tratarse de una magnitud vectorial, se representa por un vector orientado hacia el elemento más electronegativo del dipolo (H→Cl).
|
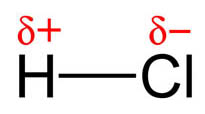 |
| Imagen 22 Lanzi, Creative commons | Imagen 23 Elaboraciòn propia |
|
Los átomos de oxígeno tienen electronegatividad alta.
| |
|
Los dos átomos de la molécula son iguales.
| |
|
En la molécula hay solamente átomos de no metal.
| |
|
Debe haber más de dos átomos para que la molécula sea polar.
|