2. Teoría de enlace de valencia
Como ya has visto, las estructuras electrónicas de Lewis tienen limitaciones: la regla del octete no siempre se cumple, los enlaces múltiples no son la suma de enlaces sencillos y, además, es necesario utilizar otra teoría (RPECV) para poder explicar la geometría de las estructuras.
Por esa razón, para explicar el enlace covalente se propuso en 1927 una nueva teoría, llamada de enlace de valencia, con un planteamiento radicalmente diferente, ya que utiliza los orbitales atómicos como elemento clave.
Según esta teoría, el enlace se forma por superposición de orbitales atómicos de dos átomos diferentes, con un electrón cada uno (orbitales semillenos, electrones desapareados). Al superponerse los dos orbitales atómicos se forma un orbital de la molécula con dos electrones, que supone la formación de un enlace entre los dos átomos.
Observa en la imagen la superposición de los orbitales en la formación de las moléculas de H2. Debajo se indica las estructura electrónica de Lewis. En la animación se simula la superposición de orbitales para formar una molécula de O2.
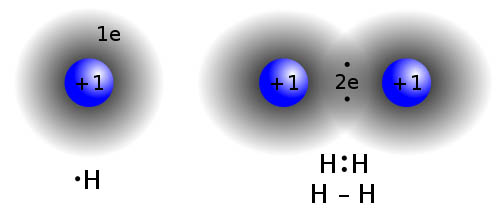 |
 |
| Imagen 11 Jazek FH, Creative commons |
Simulación 2 Kilohn Limahn, Creative commons |
Formación del enlace en la teoría de enlace de valencia
El enlace entre dos átomos se forma por superposición de dos orbitales atómicos que tienen cada uno un electrón, dando lugar a un orbital molecular, con dos electrones.