3.3 Otras estructuras carbonadas
 |
| Simulación 3 Kuiper, Creative commons |
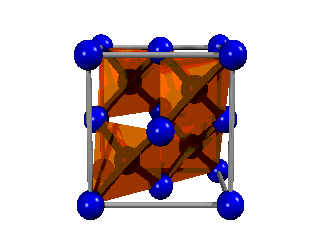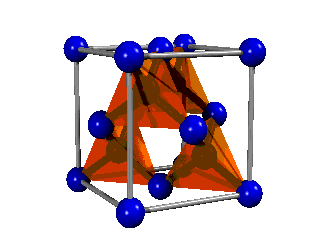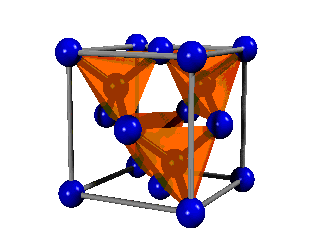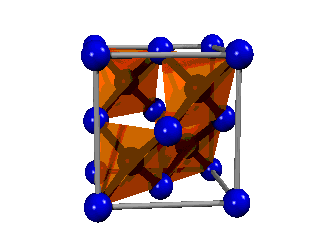
El diamante consiste en una estructura gigante de átomos de carbono distribuidos en el espacio de forma tetraédrica. En consecuencia, es fácil explicar el enlace, ya que necesariamente deben ser híbridos sp3, que son los que tienen orientación tetraédrica, los que formen el enlace. Es decir, no hay más que enlaces formados entre híbridos sp3 de dos átomos de carbono.
Fíjate en que su estructura básica es similar a la del metano (CH4) que ya has visto, de manera que los cuatro hidrógenos han sido sutituidos por otros cuatro carbonos, que a su vez se unen a otros carbonos, y así sucesivamente hasta dar lugar a la red cristalina.
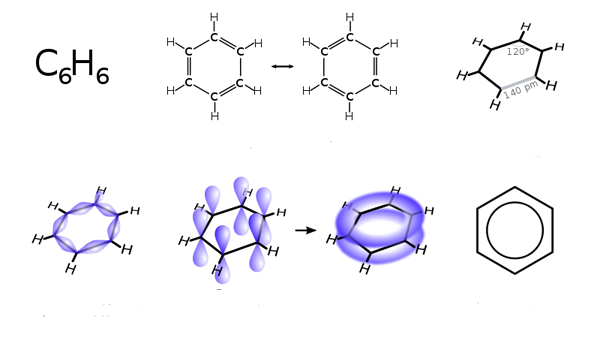
El benceno es radicalmente diferente: se trata de una molécula plana, con seis átomos que forman un anillo cerrado con ángulos de 120º entre ellos. Además, cada carbono está unido a un hidrógeno (C6H6).
En este caso, la hibridación es sp2 en cada átomo de carbono, al que le queda todavía un orbital atómico p sin hibridar.
¿Cómo se forma el enlace? Se producen seis enlaces sigma entre híbridos sp2 de átomos de dos carbonos, y otros seis enlaces sigma entre hiíbridos sp2 de un átomo de carbono y el orbital 1s de un átomo de hidrógeno. Los orbitales p restantes se solapan lateralmente, dando lugar a tres dobles enlaces alternos.
 |
| Imagen 21 Moebius1, Creative commons |
Fíjate cómo se representa el proceso en la imagen. En realidad, los tres pares de electrones de los dobles enlaces no ocupan posiciones fijas, sino que pueden estar en todo el anillo bencénico: el enlace es intermedio entre el doble y el sencillo. El benceno se suele indicar tal y como aparece en la estructura situada abajo a la derecha de la imagen anterior.