2.1 Enlaces sigma y pi
Ahora vas a ver cómo se forman algunas moléculas sencillas según la teoría de enlace de valencia.
Molécula de cloro (Cl2)
La molécula de Cl2 se explica como la de H2.
Cl: [Ne] 3s2 3px2 3py1 3pz2
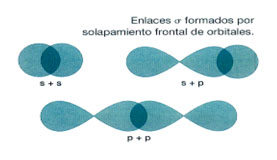
Como cada uno de los dos átomos de cloro tiene un orbital con un electrón, se superponen frontalmente los orbitales 3py de cada átomo, ya que una mayor superposición supone un enlace más fuerte y una molécula más estable. Estos enlaces frontales se llaman enlaces sigma (σ).
Como ves en la imagen, los enlaces σ pueden formarse también entre dos orbitales s o entre uno s y otro p.
En resumen, se forma un enlace sigma entre los orbitales 3py de cada átomo de cloro, por lo que los dos átomos de cloro quedan unidos por un enlace sencillo Cl-Cl.
  |
| Imagen 12 Carmen López, Uso educativo |
Molécula de oxígeno (O2)
|
| Imagen 13 Carmen López, Uso educativo |
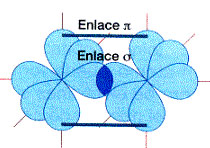
La estructura electrónica del oxígeno es O: 1s2 2s2 2px2 2py 2pz
El oxígeno formará dos enlaces puesto que tiene dos electrones desapareados. El primero será σ, entre los orbitales 2py de cada átomo, pero el segundo tendrá que ser lateral (enlace pi, ∏) entre los orbitales 2pz. Esta superposición lateral es menor, dando lugar a enlaces más débiles.
En resumen, el enlace entre los dos átomos de oxígeno es doble, pero los dos enlaces no son iguales, ya que hay uno más fuerte que el otro.
Las estructuras electrónicas de Lewis no pueden hacer esta diferenciación, y desde esa perspectiva los enlaces dobles están formados por dos enlaces sencillos iguales entre sí.
Enlaces σ y ∏
El primer enlace entre dos átomos es σ, ya que es de mayor intensidad. Los siguientes, que dan lugar a enlaces múltiples, son ∏.
Tomando como base la molécula de O2, explica el enlace en la molécula de N2.
 |
|
Imagen 14 Carmen López,
Uso educativo
|
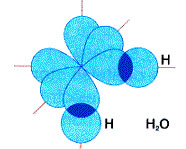
Molécula de agua (H2O)
En este caso hay que tener en cuenta las estructuras electrónicas de hidrógeno y oxígeno.
H: 1s1
O: 1s2 2s2 2px2 2py 2pz
Como el oxígeno tiene dos orbitales con un electrón, cada uno de esos orbitales se superpondrá formando dos enlaces sigma con los orbitales 1s de sendos átomos de hidrógeno, como puedes ver en la figura.
El ángulo de enlace HOH previsto será de 90º, ya que es el ángulo que forman los dos orbitales del oxígeno que producen los dos enlaces.
|
Habría demasiado hidrógeno.
| |
|
Sería necesario que el oxígeno tuviera tres orbitales con un electrón.
| |
|
Tiene que haber siempre un número par de átomos de hidrógeno.
| |
|
Podría suceder si el hidrógeno tuviera dos electrones en el orbital 1s.
|