2. Equilibrios de disociación de ácidos y bases
 |
| Imagen 6 Elaboración propia |
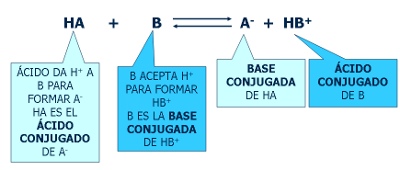
Los procesos ácido-base son reversibles. Así, cuando una sustancia HA se comporta como un ácido y cede un protón, el ión formado A- puede aceptar un protón, actuando como una base, que se llama base conjugada del ácido. Análogamente, cuando una base (B) acepta un protón, se convierte en un ácido (BH+), puesto que puede volver a ceder el protón, y que se llama ácido conjugado de la base.
Por tanto, una reacción ácido-base se puede escribir en la forma general que ves en la imagen.
Las especies de cada pareja, HA/A- y BH+/B, que toman parte en toda reacción ácido-base, reciben el nombre de pares ácido-base conjugados.
Carácter relativo del concepto de ácido y de base. Anfóteros
Conviene tener en cuenta que la reacción reversible anterior estará más o menos desplazada en uno u otro sentido según los pares ácido-base que se enfrenten. Es decir, que el concepto de ácido o de base es relativo.
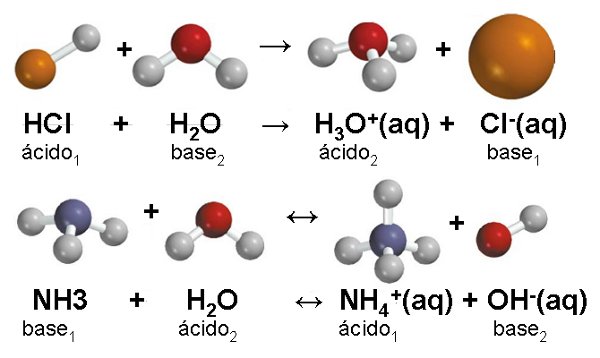
El agua frente al HCl se comporta como base y frente al NH3 se comporta como ácido, como puedes ver en la imagen.
 |
| Imagen 7 Elaboración propia |
Las sustancias que pueden comportarse como ácido o como base se llaman anfóteras.
La urea, de carácter básico frente al agua, en disolución amoniacal tiene comportamiento ácido.
| (NH2)CO(NH2) | + | H2O | ↔ | (NH2)CO(NH3)+(aq) | + | OH-(aq) |
| base1 |
ácido2 |
ácido1 |
base2 |
|||
| (NH2)CO(NH2) | + |
NH3 | ↔ | (NH2)CO(NH)-(aq) | + | NH4+(aq) |
| ácido1 |
base2 | base1 |
ácido2 |
Es decir, una sustancia anfótera tiene comportamiento ácido frente a una sustancia más básica que ella, y comportamiento básico frente a una sustancia más ácida que ella.