2.1 Ácidos y bases fuertes y débiles
Seguro que sabes que el salfumán (disolución de HCl bastante concentrada) es un ácido peligroso, mientras que el zumo de limón no, a pesar de ser también ácido: el HCl es un ácido fuerte mientras que el ácido cítrico es un ácido débil. Lo mismo sucede con las sustancias básicas: la sosa cáustica (hidróxido de sodio) es una base fuerte, mientras que el amoniaco es una base débil.
 |
 |
| Imagen 8 ISFTIC, Creative commons | Imagen 9 Walkerma, Dominio público |
¿Qué significado tienen las palabras fuerte y débil referidas a un ácido o a una base? ¿Cómo se puede medir la fuerza de un ácido o una base?
De forma cualitativa y según la teoría de Arrhenius, un ácido o una base es fuerte cuando en disolución acuosa se encuentra totalmente disociado, mientras que es débil si el grado de disociación es pequeño.
De manera análoga, en la teoría de Brönsted-Lowry un ácido será fuerte cuando muestre una gran tendencia a ceder un protón, mientras que una base fuerte presentará una gran tendencia a aceptar un protón.
Si consideras un par ácido-base cualquiera ácido ↔ base + protón (HA ↔ A- + H+) y el ácido es un ácido fuerte al tener mucha tendencia a ceder un protón, necesariamente su base conjugada deberá tener poca tendencia a captar protones, por lo que será una base débil. Recíprocamente, si el ácido se comporta como un ácido débil, su base conjugada deberá tener mucha tendencia a captar protones, por lo que será una base fuerte.
En realidad, cuando un ácido cede protones lo hace a una base (distinta de la propia conjugada) de manera que, realmente, la tendencia del ácido a ceder protones depende de la naturaleza de la base con la que reacciona. Por esta razón el ácido ácetico es un ácido débil frente al agua y un ácido fuerte frente al OH-.
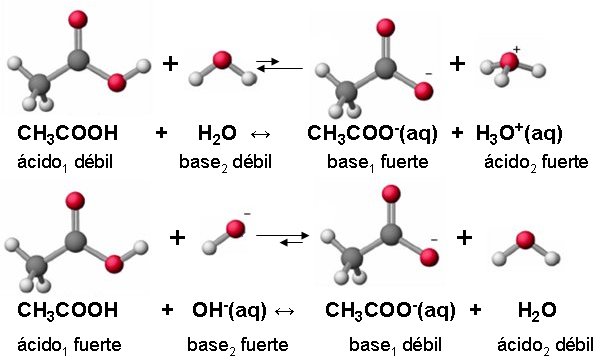 |
| Imagen 10 Elaboración propia |
Así, al establecer una escala cuantitativa que permita relacionar la fortaleza de ácidos y bases, conviene elegir una sustancia a la que referir de manera común la fuerza de los distintos ácidos y bases. Como el agua es el medio en el que tienen lugar la mayor parte de las reacciones ácido-base y es, además, una sustancia que se comporta como base débil frente a muchos ácidos y como ácido débil frente a muchas bases, se ha optado por elegirla como sustancia de referencia para expresar la fortaleza relativa de ácidos y bases.
Ácidos y bases fuertes y débiles
En la tabla siguiente tienes los ácidos y bases fuertes y débiles que debes saber. En los demás casos, podrás saber si una sustancia es ácido o base débil porque te darán la constante de equilibrio.
| Ácido fuerte |
Ácido débil | Base fuerte | Base débil |
| HCl | CH3COOH (HAc) | NaOH | NH3 |
| HNO3 | H2CO3 | Hidróxidos | |
| H2SO4 | H2S |
Fuerza de ácidos y bases
El carácter ácido o básico de una sustancia es relativo, dependiendo de la sustancia con la que se compare. La fuerza de un ácido o de una base también es relativa y depende de la sustancia de referencia.
Se ha elegido el agua para determinar si una sustancia es ácida o básica, midiendo su fuerza relativa al agua.
De las siguientes proposiciones, referentes a los ácidos y las bases, según la teoría protónica de Brönsted y Lowry, señala la que consideres correcta:
|
Un ácido y su base conjugada
difieren en un protón. | |
|
La base conjugada de un ácido fuerte es una base fuerte. | |
|
Un ácido y su base conjugada reaccionan entre sí para formar una disolución neutra. | |
|
Un ácido y su base conjugada reaccionan entre sí dando lugar a una sal y agua. |