3. Equilibrio iónico del agua
Aunque se dice que el agua pura es una sustancia no conductora de la electricidad, en realidad tiene una conductividad muy pequeña, que puede medirse con aparatos muy sensibles. Esta conductividad indica que en agua pura deben existir iones, pero en concentraciones muy pequeñas. Esto significa que el agua debe estar disociada en la forma que se ve en la imagen, proceso conocido como autoionización del agua:
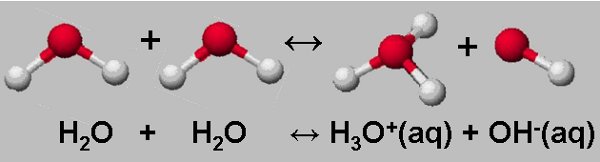 |
| Imagen 12 Elaboración propia |
Teniendo en cuenta que la concentración del agua es prácticamente constante (1000 gramos de agua por litro y 18 gramos por mol son 55,5 mol/litro), puede incluirse en la constante de equilibrio, que se expresa entonces en la forma:
Esta constante, Kw, se llama producto iónico del agua. En los problemas que se te planteen, siempre que no indiquen otra cosa, vas a suponer que siempre trabajas con agua y con disoluciones a 25 ºC.
Para que te hagas una idea, se ionizan solamente 2 de entre 555 millones de moléculas de agua. En consecuencia, la reacción contraria (neutralización) entre los iones OH- y H3O+ para formar agua se realizará de forma prácticamente total.
Fíjate en que en agua pura las dos concentraciones iónicas deben ser iguales, al formarse igual cantidad de H3O+ que de OH-, siendo cada una de 10-7, ya que su producto es de 10-14.
Ya sabes que Kw es 10-14 a 25 ºC. Su valor, como el de todas las constantes de equilibrio, depende de la temperatura. Por ejemplo, a 40 ºC es de 3 10-14.
Si en un recipiente mezclas disoluciones de HCl y de NaOH, ambas a temperatura ambiente, ¿la mezcla se enfriará o se calentará por efecto de la neutralización?