2.2 Constantes y grado de disociación
De una manera cuantitativa, la fuerza de un ácido (o de una base) puede expresarse mediante el valor de la constante del equilibrio de reacción de dicho ácido (o base) con agua (sustancia de referencia).
Así, para el caso general de un ácido HA el proceso es: HA + H2O ↔ A-(aq) + H3O+(aq).
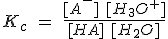
En disoluciones acuosas diluidas, que son las que se manejan corrientemente, la concentración del agua permanece prácticamente constante (igual a la del agua pura, 55,5 mol/L), por lo que puede incluirse en la constante de equilibrio, con lo que resulta:
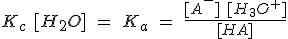
Esta constante Ka se llama constante de disociación o de ionización (a veces constante de acidez), y mide cuantitativamente la fuerza del ácido HA respecto al agua. Cuanto mayor sea el valor de Ka, mas fuerte será el ácido (y más débil su base conjugada A-).
De forma análoga se procede para la fuerza de una base B:
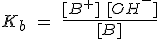
siendo Kb la constante de disociación o de ionización de una base (constante de basicidad), que mide la fuerza de una base.
Grado de disociación
En términos de equilibrio químico, un ácido o una base es fuerte si su equilibrio de disociación está totalmente desplazado a la derecha, en el sentido de la ionización.
Se suele utilizar el grado de disociación, que es el porcentaje de sustancia disociada. Si x es la concentración disociada y c0 la concentración inicial de sustancia, el grado de disociación es:
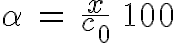
Los ácidos fuertes como HCl, HNO3 o H2SO4, están disociados prácticamente en un 100% en disoluciones acuosas no demasiado concentradas.
Se podría concluir que estos ácidos tienen la misma fuerza. Sin embargo, esto no parece muy razonable si tienes en cuenta las notables diferencias que existen en la estructura molecular de estos ácidos. La razón de esta apariencia reside en el hecho de que el agua se comporta frente a estos ácidos como una base fuerte y retiene con intensidad el protón que le han cedido, originando así una transferencia prácticamente total del mismo. El agua, en este sentido, nivela las fuerzas de los llamados ácidos fuertes en disolución acuosa y decimos, por ello, que es un disolvente nivelador de la fuerza de los ácidos.
Un ácido o base es tanto más débil cuanto menor es el grado de ionización. En los ácidos o base muy débiles, el grado de ionización puede ser menor del 1%.
En la simulación puedes ver que el HCl está totalmente ionizado, de acuerdo con el proceso
HCl + H2O → Cl-(aq) + H3O+(aq)
mientras que HA está ionizado en una proporción pequeña: en la simulación solamente se ve a dos moléculas que se ionizan, transfiriendo protones según el proceso
HA + H2O ↔ A-(aq) + H3O+(aq)
|
|
|
| Simulación 2 Proyecto TIGER, Uso educativo |
Simulación 3 Proyecto TIGER, Uso educativ |
Ácidos y bases fuertes y débiles
Son fuertes su el grado de disociación es del 100%, y débiles si es menor, siendo frecuente que sea del orden del 1%.
¿Cual de los siguientes ácidos A (Ka = 2,9 10-8), B (Ka = 6,2 10-10), C (Ka = 1,9 10-5) y D (Ka = 6,3 10-5) es el más débil?
|
El A.
| |
|
El B.
| |
|
El C.
| |
|
El D.
|