1.2 Teoría de Brönsted- Lowry
Ya has visto que el protón no existe libre en disolución acuosa, y por lo tanto es incorrecto representar la disociación de un ácido mediante la reacción: HA → H+ + A-. A partir de ahora designarás al protón en disolución acuosa como H3O+ (aq). Así pues, hay que escribir:
HA + H2O → H3O+ (aq) + A-(aq)
Esta reacción puede interpretarse como una transferencia de un protón H+ del ácido al agua.
En 1923, Brönsted y Lowry consideraron todas las reacciones ácido-base desde este punto de vista. Formularon de forma simultánea e independiente una nueva definición de ácidos y bases, más general que la de Arrhenius y que puede aplicarse a disolventes no acuosos.
Base es una sustancia capaz de aceptar un protón (de un ácido).
Las reacciones ácido-base son reacciones de transferencia de protones.
| |
Ejemplos de ácidos de Brönsted y Lowry | Ejemplos de Bases de Brönsted y Lowry |
| Moleculares |
HCl + H2O ↔ H3O+ (aq) + Cl-(aq) H2SO4 + H2O ↔ H3O+ (aq) + HSO4-(aq) |
NaOH + H2O ↔ Na+ (aq) + OH-(aq) NH3 + H2O ↔ NH4+ (aq) + OH-(aq) |
| Aniones |
HSO4-(aq) + H2O ↔ H3O+ (aq) + SO42-(aq) HCO3-(aq) + H2O ↔ H3O+ (aq) + CO32-(aq) |
HSO4-(aq) + H3O+ (aq) ↔ H2SO4 + H2O CO32-(aq) + H2O ↔ HCO3-(aq) + OH-(aq) |
| En general | HA + H2O ↔ H3O+ (aq) + A-(aq) | B + H2O ↔ B+/BH+ (aq) + OH-(aq) |
Debes tener presente que sólo se puede hablar de ácido si hay una base y viceversa.
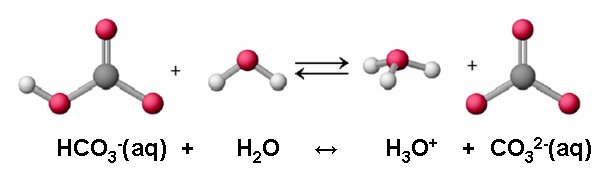 |
| Imagen 5 Elaboración propia |
En la teoría de Brönsted y Lowry las sustancias consideradas ácidas en la teoría de Arrhenius continuan siendo ácidas, pero se hace evidente que para que el ácido se manifieste es necesaria la presencia de una base. Amplía el concepto de ácidos a partículas cargadas: HS-, HSO4-, H2PO4- y NH4+ entre otros, pero presenta notables diferencias en el concepto de bases, ya que incluye moléculas neutras e iones, tales como amoniaco, aminas, ión carbonato, ión sulfuro, ión bicarbonato o ión bisulfuro, cuyo comportamiento como bases era difícil de explicar en la teoría de Arrhenius.
Además, permite considerar reacciones ácido-base que no transcurren en medio acuoso y en las que no intervienen iones H3O+ (aq) y OH-(aq), como es el caso de NH4+ + NH2- ↔ NH3 + NH3. No obstante, por simplificar un poco, a partir de ahora solamente vas a trabajar con disoluciones acuosas.
Esta teoría comprende prácticamente todas las sustancias que se comportan como bases, pero limita el concepto de ácido a las sustancias que contienen hidrógeno. En cambio, existen muchas sustancias que no contienen hidrógeno, por lo que no pueden ceder protones, y, sin embargo, se comportan experimentalmente como ácidos: SO3, SO2, CO2, BF3, AlCl3, Ag+, Al3+, etc. Por tanto, también esta teoría presenta sus limitaciones.
|
HCO3- + H3O+ ↔ CO2 + 2 H2O
| |
|
HCO3- + H2O ↔ H2CO3 +
OH-
| |
|
HCO3- + OH- ↔ CO32- + H2O | |
|
HCO3- + HBO2 ↔ H2O + CO2 + BO2- |