4.1 Polaridad y geometría molecular
Cuando la molécula es diatómica, la situación es muy sencilla: si los átomos tienen la misma electronegatividad, el enlace y la molécula son apolares, y si son diferentes, polares. Por ejemplo, son los casos de Cl2 y de HCl.
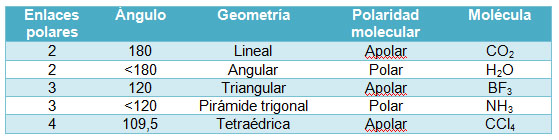
Si hay dos enlaces entre tres átomos, puede darse el caso de que teniendo enlaces polares la molécula sea polar, como es el caso del agua, o apolar, como sucede en el dióxido de carbono. ¿A qué se debe?
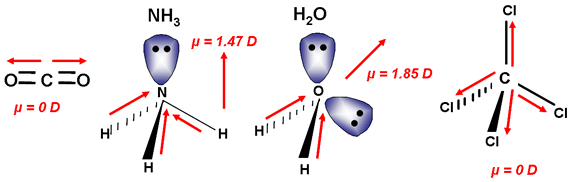
Si una molécula tiene varios enlaces polares, pueden compensarse sus separaciones de cargas (sus momentos dipolares de enlace), según sea la geometría de la molécula. Fíjate en el caso del CO2, que es una sustancia apolar, a pesar de que los enlaces entre el carbono y el oxígeno son polares, ya que el oxígeno es apreciablemente más electronegativo que el carbono, y los electrones de enlace están desplazados hacia él. La causa de que la molécula sea apolar es que su geometría es lineal, con lo que los dos vectores momento dipolar de enlace son de igual módulo y dirección pero de sentidos contrarios.
Por el contrario, como el agua es angular, los dos momentos dipolares de enlace no se anulan, y la molécula es polar (se representa el momento dipolar resultante).
Si hay más de dos enlaces, el análisis es similar: el NH3 es polar debido a su geometría de pirámide trigonal, mientras que el BF3 es apolar, por ser triangular plana (la resultante de tres vectores de igual módulo que forman un ángulo de 120º es nula).
El CCl4 es apolar por la misma razón: la resultante de los cuatro vectores momento dipolar de enlace es nula si su geometría es tetraédrica.
 |
| Imagen 24 Diego JP, Creative commons |
En la tabla siguiente puedes ver los casos que se plantean en casos muy conocidos de moléculas del tipo AB2, AB3 y AB4, que tienen dos, tres o cuatro enlaces polares iguales.