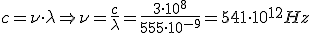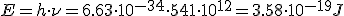3. Modelo atómico de Bohr
 |
| Imagen 9 Alchemist-hp, Creative commons |
Uno de los avances fundamentales en el conocimiento de la estructura atómica vino originado por el trabajo de los espectroscopistas, que durante la segunda mitad de siglo XIX se dedicaron a recoger las impresiones fotográficas que dejaba la radiación (habitualmente luz) emitida por los diferentes elementos químicos conocidos. Esos registros se conocen con el nombre de espectros. Para obtenerlos, se comunicaba una gran cantidad de energía a la sustancia, mediante calor o chispa eléctrica, y utilizando un espectroscopio se analizaba y registraba la radiación emitida.
Los espectros atómicos no se podían explicar con la teoría de Rutherford, haciendo necesaria la introducción de un nuevo modelo atómico.
Características de la radiación emitida por los átomos
|
|
| Vídeo 3 IESRJSFyQ, uso libre |
Cuando se calienta sodio o una sal de sodio a la llama, se emite un luz amarillo-naranja muy intensa. En otros casos, la luz es verde, o de otros colores. Y en otras ocasiones, la radiación emitida no es visible por el ojo humano.
La energía de la radiación se caracteriza por su frecuencia 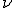 , y también por su longitud de onda
, y también por su longitud de onda 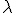 . Estas dos magnitudes están relacionadas de la forma
. Estas dos magnitudes están relacionadas de la forma 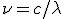 , donde c es la velocidad de la luz (3.108 m/s).
, donde c es la velocidad de la luz (3.108 m/s).
La energía de la radiación emitida viene dada por la expresión 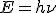 , donde E es la energía (J),
, donde E es la energía (J), 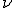 es la frecuencia (Hz) y h es la conocida como constante de Planck, de valor h = 6.63·10-34 J·s.
es la frecuencia (Hz) y h es la conocida como constante de Planck, de valor h = 6.63·10-34 J·s.
De esta ecuación se deduce que cuanto mayor sea la frecuencia de una radiación, mayor será su energía. La radiación infrarroja es de menor frecuencia que la visible, y ésta menor que la ultravioleta y los rayos X. De ahí que los rayos X sean más nocivos para la salud que la radiación infrarroja o la luz emitida por una bombilla.
 |
| Imagen 10. Wikimedia, dominio público |
a) La frecuencia de dicha radiación.
b) La energía de la misma.