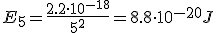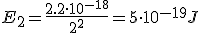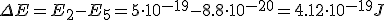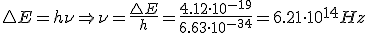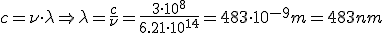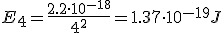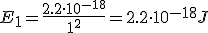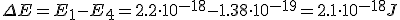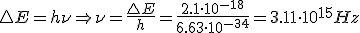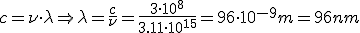3.2 Modelo atómico de Bohr
En 1912, el físico danés Niels Bohr propuso un nuevo modelo para explicar la estructura atómica, en el cual los electrones no giraban en torno al núcleo a cualquier distancia, sino que únicamente lo hacían en ciertas "órbitas" permitidas. Las hipótesis principales del modelo atómico de Bohr eran las siguientes
 |
| Imagen 13. JabberWok Licencia GNU |
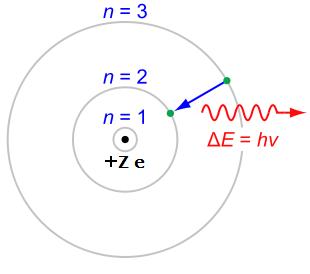
Modelo atómico de Bohr
- Los electrones giran en torno al núcleo de forma que tienen valores concretos ("cuantizados") de energía. Por lo tanto, no todas las órbitas están permitidas, sino únicamente un número finito de éstas. Estas órbitas se caracterizan por un número entero n denominado número cuántico principal. El nivel de menor energía toma el valor n = 1, y los sucesivos n = 2,3,4,... conforme aumenta su energía.
- Los electrones no pierden energía en su movimiento, pudiendo ganar o perder energía al saltar entre órbitas permitidas. El salto entre niveles energéticos implica la emisión o absorción de la energía correspondiente a la diferencia de energía entre el nivel emisor y el receptor. Esa energía viene dada por la relación de Planck:
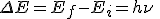
Este modelo permitía explicar las líneas que aparecen en el estudio de los espectros atómicos, pues en el espectro de emisión correspondían a las longitudes de onda o las frecuencias de la energía emitida cuando un electrón excitado retornaba a un nivel de energía desde otro nivel superior.
Experimentalmente se comprobó que la energía de un nivel venía dada por la siguiente ecuación:
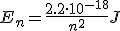
En el caso del átomo de hidrógeno, cuyos espectros de emisión y absorción has podido ver en el apartado antes, las líneas que aparecen corresponden exactamente con las transiciones electrónicas entre niveles energéticos, dando lugar a 4 series espectrales principales, que reciben el nombre de sus descubridores:
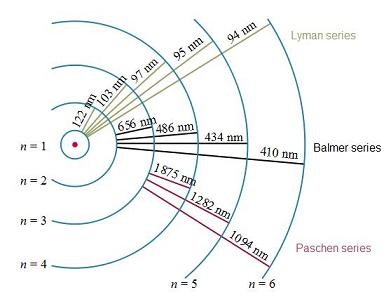
- Serie de Lyman: correspondientes a las transiciones que tienen como nivel final el primero (n = 1).
- Serie de Balmer: correspondientes a las transiciones que tienen como nivel final el segundo (n = 2).
- Serie de Paschen: correspondientes a las transiciones que tienen como nivel final el tercero (n = 3)
- Serie de Brackett: correspondientes a las transiciones que tienen como nivel final el cuarto (n = 4)
Los espectros mostrados corresponden a la serie de Balmer, que es aquella cuya longitud de onda entra dentro del rango del visible, y es, por tanto, radiación luminosa.
En la siguiente imagen puedes observar las líneas espectrales correspondientes a las tres primeras series:
 |
| Imagen 14. Szdory Licencia GNU |
Calcula la longitud de onda de la energía emitida por un átomo de hidrógeno cuando su electrón cae del estado n=5 al estado n=2
¿A qué serie corresponde dicha línea?
Calcula la longitud de onda la energía emitida por un átomo de hidrógeno cuando su electrón cae del estado n=4 al estado n=1