3.3 Números cuánticos y niveles de energía
Al mejorar los espectroscopios se observó cómo la mayor parte de las líneas observadas no eran tales, sino una acumulación de varias de ellas con una energía prácticamente similar. Este desdoblamiento, no explicable según el modelo de Bohr, parecía indicar la existencia de unos niveles de energía más "finos", agrupados en torno a los niveles predichos por el modelo de Bohr. Por esa razón se denominaron subniveles.
El estudio de estos subniveles mostró que el primer nivel de energía (n = 1) no se desdoblaba, el segundo (n = 2) presentaba 2 subniveles, el tercero (n = 3) presentaba 3 subniveles y así sucesivamente para sucesivos valores del número cuántico principal n.
Para explicar este desdoblamiento se introdujo un segundo número cuántico, el número cuántico secundario, denotado por la letra l, y que para un determinado nivel principal toma valores desde 0 hasta n-1.
Debido a la detección espectroscópica de estos niveles, se ha mantenido su notación original, que asocia una letra a cada valor de l, según se observa en la siguiente tabla:
| Valor del nº cuántico secundario (l) |
0 | 1 |
2 |
3 |
| Letra asociada |
s | p |
d |
f |
Para explicar los niveles y subniveles electrónicos de un átomo se necesitan dos números cuánticos:
- Número cuántico principal (n), que determina la energía y la distancia promedio de la órbita al núcleo. A mayor valor de n, mayor es la energía del nivel electrónico y mayor la distancia al núcleo atómico. Toma valores enteros positivos comenzando en 1:
n = 1, 2, 3,....
- Número cuántico secundario (l), indica el subnivel energético en el que se encuentra el electrón. Toma valores enteros positivos desde 0 hasta n-1 y se denota con la letra correspondiente al valor de l: l = 0 → s, l = 1 → p, l = 2 → d, l = 3 → f.
l = 0, .... , n-1
Para un mismo nivel de energía (igual n), la energía de los subniveles aumenta al hacerlo el número cuántico secundario (l), pero la diferencia entre ellas es pequeña.
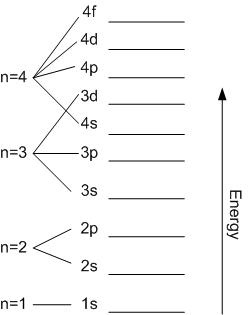
Según esto, los niveles electrónicos de un átomo se desdoblan en subniveles, tal y como se muestra en la siguiente imagen, en la que se ordenan en orden creciente de su energía.
La notación de los distintos subniveles es del tipo nx, donde n es el nº cuántico principal y l la letra correspondiente al número cuántico secundario del subnivel. Así, por ejemplo, el nivel 3p será aquel en el que n = 3 y l = 1, ya que la letra p corresponde al valor 1 para el número cuántico secundario.
Observa cómo el nivel 4s se solapa con el 3d, pues su energía es menor.
|
| Imagen 15. Niall Jackson Licencia Creative Commons |
 |
| Imagen 16. Falcorian Licencia Creative Commons |
El modelo de Bohr supone que los electrones "orbitan" en torno al
núcleo en órbitas circulares, lo cual se demostró que no era cierto, ya que al aplicar un campo magnético se observaba cómo existían distintos comportamientos dentro de un mismo subnivel.
Las teorías modernas, basadas en la mecánica cuántica ya no hablan de órbitas, sino de orbitales,
que son las regiones del espacio en las que existe mayor probabilidad de
encontrar un electrón situado en un subnivel de energía dado.
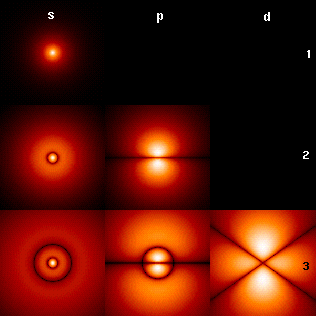
La forma de estos orbitales depende del número
cuántico secundario l, tomando distintas formas y orientaciones en el
espacio según sea su valor. En la imagen puedes observar la
distribución de los distintos orbitales para un átomo de hidrógeno.
Una consecuencia de esta teoría es que no todos los subniveles tienen el mismo número de orbitales, sino que es función de su número cuántico secundario.
Concretamente, cada subnivel tiene (2·l+1) orbitales. Así:
- Un subnivel s (l = 0) tiene 1 único orbital
- Un subnivel p (l = 1) tiene 3 orbitales
- Un subnivel d (l = 2) tiene 5 orbitales
- Un subnivel f (l = 3) tiene 7 orbitales
Esto, como verás en el siguiente apartado, tendrá consecuencias en el número de electrones que puede contener cada subnivel.
Justifica si son posibles las siguientes combinaciones de número cuántico principal y secundario (n,l) e indica, en caso de ser correcta, el número de orbitales de dicho subnivel:
(3,2)
(2,2)
(4,0)
Indica cuáles de las siguientes afirmaciones son verdaderas:
La energía del nivel n = 2 es mayor que la energía del nivel n = 3.
Verdadero Falso
Un subnivel d corresponde a un número cuántico principal n = 2.
Verdadero Falso
Un subnivel con l = 3 tiene siete orbitales.
Verdadero Falso