2. Modelo atómico de Rutherford
En la primera década del siglo XX, Ernest Rutherford realizó un experimento bombardeando una fina lámina de oro con partículas alfa, cargadas positivamente (en ese momento Rutherford lo desconocía, pero se trataba de núcleos de Helio). Colocando una pantalla fluorescente detrás del haz de partículas α, podía observar dónde impactaban éstas.
El montaje experimental y los resultados obtenidos puedes observarlos en el siguiente vídeo:
|
|
|
Vídeo 2. Cosmolearning, YouTube
|
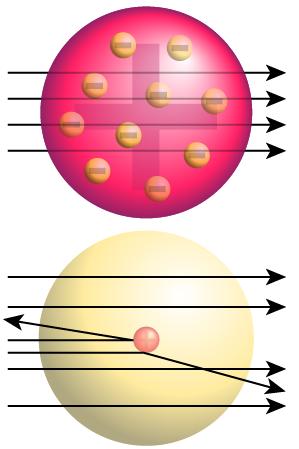 |
| Imagen 4. Fastfission, dominio público |
El resultado del experimento fue absolutamente inesperado, tal y como puedes observar en la imagen: en la parte superior se observa el resultado que cabría esperar según el modelo de Thomson, y en la parte inferior lo que se observó realmente.
Concretamente, los resultados del experimento indicaban que :
- La mayor parte de las partículas α atravesaban la lámina sin desviarse.
- Una pequeña proporción de ellas atravesaba la lámina, pero desviándose ligeramente.
- Y lo más sorprendente: en torno a una de cada 10000 partículas rebotaba en la lámina y volvía hacia el emisor. En palabras de Rutherford, "era como si al disparar una bala contra un papel de fumar, en lugar de atravesarlo, rebotara"
La explicación que dio Rutherford fue que la masa y la carga positiva del átomo estaban concentradas en un volumen muy pequeño del átomo en vez de distribuidas por todo el mismo. La mayor parte del espacio en torno a estos "centros positivos", que denominó núcleo atómico, era vacío, con los electrones situados orbitando en torno al núcleo de forma similar a como los planetas orbitan en torno al sol.
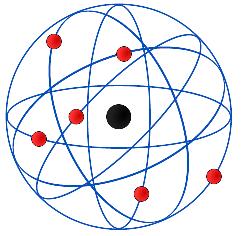 |
| Imagen 5. Cburnett, Creative commons |
a) Los átomos son, en su mayor parte, espacio vacío.
| |
b) Los átomos tienen su masa distribuida uniformemente en todo su volumen. | |
c) El núcleo del átomo es neutro.
| |
d) Los electrones se encuentran fuera del núcleo, orbitando en torno a él.
| |