3.1 Desplazamiento del equilibrio del agua
Al disolver un ácido en agua pura, la disolución se vuelve ácida, y ya no es cierto que [OH-] = [H3O+]: como el ácido aporta iones H3O+ a la disolución, aumentará la [H3O+] (será mayor de 10-7), con lo cual el equilibrio de disociación del agua se desplazará hacia la izquierda, de acuerdo con el principio de Le Chatelier. Por tanto, disminuirá la [OH-] (se hará menor que 10-7), de tal forma que el producto de ambas concentraciones, Kw, permanezca constante.
Esta influencia que ejercen los iones H3O+ sobre la concentración de los iones OH- es un caso particular del fenómeno que ya conoces llamado efecto del ión común. En este caso, el H3O+ es el ión común entre el agua y el ácido: al aumentar la [H3O+], disminuye la autoionización del agua.
De forma análoga, si en agua pura se disuelve una base (disolución básica), aumentará la concentración de iones OH- y disminuirá, en la misma proporción, la concentración de iones H3O+, de forma que Kw también permanezca constante.
En resumen, las disoluciones acuosas son neutras, ácidas o básicas, cuando:
| Disolución acuosa | A cualquier temperatura | A 25 ºC, en mol L-1 |
| Neutra | [H3O+] = [OH-] |
[H3O+] = [OH-] = 10-7 |
| Ácida | [H3O+] > [OH-] |
[H3O+] > 10-7 |
| Básica | [H3O+] < [OH-] | [H3O+] < 10-7 [OH-] > 10-7 |
Fíjate en que ni [OH-] ni [H3O+] pueden ser cero, ya que entonces sería Kw = 0. Esto significa que en disoluciones
ácidas siempre hay presentes iones OH-, aunque en una concentración muy pequeña, y lo mismo ocurre con los iones H3O+ en disoluciones
básicas.
La relación existente entre [OH-] y [H3O+] en disolución acuosa
también relaciona las constantes de acidez, Ka, y de basicidad, Kb, de cualquier
par ácido-base conjugados.
Observa las expresiones en el par ácido acético (CH3COOH) y su base conjugada, ión acetato (CH3COO-).
| CH3COOH(aq) | + |
H2O | ↔ | CH3COO-(aq) |
+ | H3O+(aq) |  |
| CH3COO-(aq) | + |
H2O | ↔ | CH3COOH(aq) |
+ | OH-(aq) | 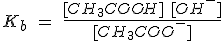 |
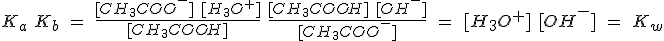
Esta relación permite calcular Kb a partir de Ka, o viceversa. Por
ello, hay tablas con valores de la constante de acidez o basicidad de las sustancias, pero no de sus bases o ácidos conjugados.
En el tema siguiente utilizarás esta relación cuando veas los procesos de hidrólisis.
a) Cuál es el ácido más debil.
b) Cuál es el que posee la base conjugada más débil.
c) El carácter fuerte o débil de A-.
|
[H3O+] = 10-7.
| |
|
[OH-] = 0.
| |
|
Las concentraciones de H3O+ y de OH- son diferentes. | |
|
[H3O+] = [OH-]. |