5.1 Medida del pH
Cada indicador tiene un intervalo de viraje característico, es decir, un entorno más o menos reducido de unidades de pH dentro del cual se realiza el cambio de color. Un indicador es tanto más útil cuanto menor es su intervalo de viraje y de forma más clara tiene lugar el cambio de color.
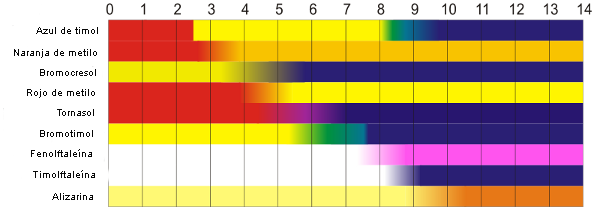
En la imagen puedes ver algunos indicadores ácido-base junto con su intervalo de viraje y el color que presentan en su forma ácida y básica.
 |
| Imagen 17 MarkusZi, Dominio público |
Medida del pH utilizando indicadores
El pH de una disolución se puede medir aproximadamente utilizando indicadores. Para ello, hay que preparar varias muestras de la disolución en tubos de ensayo, y añadir a cada uno unas gotas de indicador. Según el color que toma cada uno se puede ir acotando el valor del pH de la disolución hasta aproximadamente una unidad.
|
Son ácidos o bases débiles.
| |
|
Todos tienen su pH de viraje en la zona neutra.
| |
|
No existen sustancias naturales que viren de color en función del pH del medio.
| |
|
Los indicadores son generalmente sustancias inorgánicas.
|
Considerando un indicador que es ácido débil, HIn + H2O ↔ In- + H3O+, la constante de acidez es:
Si tomas logaritmos, cambias de signo y despejas, obtienes que:
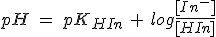
Por tanto, puedes escribir que:
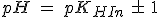
En resumen, si la relación de concentraciones está dentro del intervalo en que una es menor de diez veces la otra, el color no está totalmente definido, y el indicador se encuentra en la zona de viraje, que tiene una anchura de dos unidades de pH (el pKHIn ± 1).
Con la expresión del pH también puedes ver por qué los indicadores cambian de color en diferentes zonas de pH: el bromotimol vira sobre 7, mientras que el naranja de metilo lo hace sobre 3. El punto medio de la zona de viraje corresponderá al color intermedio, que se dará cuando las concentraciones de las dos formas sean iguales, con lo que pH = pKHIn. Como las constantes de acidez (o basicidad) son distintas para los diferentes indicadores, viran en zonas de pH diferentes.
Por último, fíjate en el azul de timol, que tiene tres colores diferentes -rojo, amarillo y azul- con dos zonas de viraje. Necesariamente deberá tener tres formas con colores distintos, para lo que deberá ser un ácido con dos protones, H2In, que da lugar a HIn- en una primera ionización, y In2- en una segunda fase.