3.6 Número de oxidación
Los átomos tienden a combinarse formando sustancias, simples (formadas por átomos iguales) o compuestas (en las que hay átomos o iones de elementos diferentes). Esa capacidad de combinación ha venido medida tradicionalmente por la valencia, que se indicaba en números romanos: valencia II significaba que los átomos del elemento formaban dos enlaces.
Actualmente, se utiliza el número de oxidación. Si en la sustancia hay iones monoatómicos (Fe2+, O2-), el número de oxidación es la carga real de cada ión, pudiendo ser positiva o negativa, según pierda o gane electrones al formase la sustancia. En el ejemplo anterior, el hierro tiene un número de oxidación de +2, mientras que el del oxígeno es -2.
Si no se forman iones, el número de oxidación es la carga que tendría cada uno de los átomos unidos si se hubiesen formado iones. Su signo depende de las electronegatividades relativas de los átomos unidos: el más electronegativo tiene número de oxidación negativo, porque atrae más a los electrones de enlace. Por ejemplo, en el H2O el número de oxidación del H es +1 y el del O es -2 (aunque no son iones que tengan esa carga).
En la tabla periódica de la simulación 2 puedes ver los números de oxidación de todos los elementos. Observa que se indica valencia en lugar de número de oxidación.
Números de oxidación más habituales
El número de oxidación de un elemento en una sustancia depende de la estructura electrónica de los átomos del elemento.
Fíjate en los alcalinos: como has visto, tienen tendencia perder un electrón, para quedarse con su capa más externa completa, formando iones monopositivos. Por tanto su número de oxidación es +1. Por la misma razon, en todos los alcalinotérreos es +2.
En los halógenos, el número de oxidación debe ser-1, ya que ganan un electrón para completar su capa electrónica más externa. Sin embargo, fíjate en que en cloro, bromo y yodo se indica también +1, +3, +5 y +7. Al estudiar el enlace químico sabrás la razón.
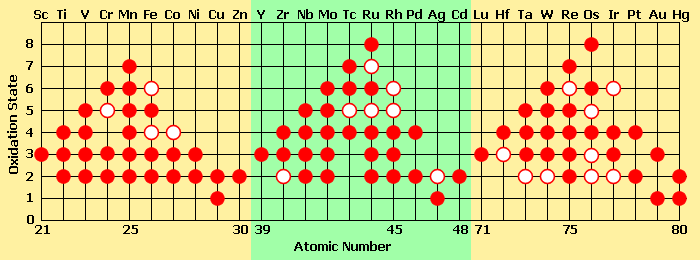
De momento, observa la imagen siguiente, en la que aparecen los números de oxidación de los elementos de transición. Fíjate en que no siguen ninguna regla. Por ejemplo, Cu, Ag y Au están en el grupo 11, pero el Cu tiene números de oxidación +1 y +2, la Ag +1 y el Au +1 y +3.
 |
| Imagen 17 Felix Wan, Creative commons |