3.5 Carácter metálico
|
|
| Vídeo 2 Nuclearrabbit, Uso libre |
Los metales son los elementos que tienen tendencia a perder electrones, formando iones positivos. Ese proceso se llama oxidación. Por el contrario, los no metales ganan electrones, reduciéndose.
La mayor parte de los elementos conocidos son metales, y se conocen desde la antigüedad: hierro, cobre, oro, plata, etc.
¿Dónde están los metales en la tabla periódica? En la parte izquierda, mientras que los no metales se encuentran a la derecha. Los gases nobles no tienen carácter metálico o no metálico.
Los elementos son más reactivos cuanto más metálicos o más no metálicos son, ya que entonces tienen más tendencia a transferir electrones, oxidándose en unos casos y reduciéndose en otros.
Fíjate en la violencia de la reacción del litio con agua, formándose hidróxido de litio en disolución y desprendiéndose hidrógeno según indica la ecuación del proceso
2 Li(s) + 2 H2O → 2 LiOH(aq) + H2(g)
Carácter metálico y electronegatividad
Los metales son elementos con electronegatividad baja, mientras que los no metales tienen electronegatividad alta.
Semimetales
Hay un conjunto de elementos que tienen electronegatividades intermedias y que presentan características tanto de metales como de no metales. Estos elementos se conocen como semimetales o metaloides (en rojo en la tabla de la imagen).
El más típico es el silicio, que tiene una conductividad de la corriente eléctrica próxima a la de los metales (toda la moderna tecnología electrónica se basa en circuitos integrados de silicio). Aunque no hay un consenso generalizado sobre cuáles son los semimetales, en la imagen puedes ver una de las clasificaciones más habituales.
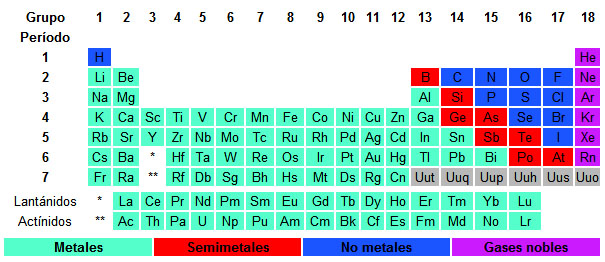 |
| Imagen 16 Elaboración propia |
Los no metales tienen tendencia a oxidarse.
| |
Si un elemento se reduce con facilidad, es no metálico.
| |
Los no metales se encuentran a la izquierda de la tabla periódica.
| |
Cuanto más abajo se encuentre un elemento en la tabla periódica, menor será su electronegatividad.
| |