3.4 Electronegatividad
La electronegatividad es un concepto químico más bien que una propiedad de los elementos aunque, por supuesto, el valor de dicha magnitud depende de su comportamiento químico.
La electronegatividad (EN) mide la mayor o menor atracción -y, por tanto, desplazamiento- que un átomo ejerce sobre el par de electrones de un enlace con otro átomo.
Al ser un concepto químico no tiene unidades y su valor se realiza a partir de una escala. La escala que más se utiliza es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7.
Ésta es la propiedad relevante en relación con la capacidad de combinación de los átomos y el tipo de enlace que forman.
Fíjate en la imagen para deducir cómo evoluciona la EN. El color rojo indica valores altos de la propiedad, y el amarillo valores bajos. El color gris indica que no hay datos: como los gases nobles no forman enlaces, no se puede determinar EN para ellos.
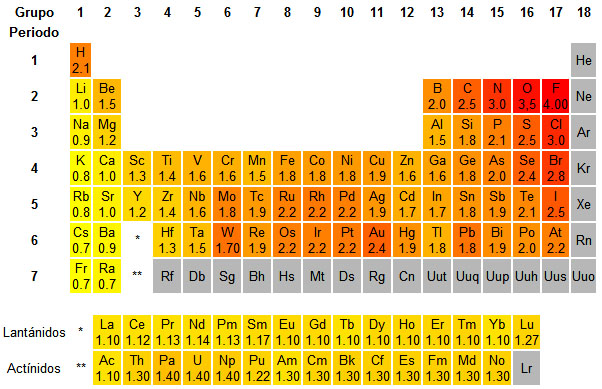
|
| Imagen 15 Elaboración propia |
Variación de la electronegatividad
La electronegatividad es máxima para los elementos con gran tendencia a captar electrones, situados en la parte derecha de la tabla, y mayor cuanto menor es la capa en la que se encuentran, debido a su cercanía al núcleo. Es mínima en los elementos con tendencia a perder electrones, situados a la izquieda de la tabla, y menor cuanto más grande es la capa en la que están los electrones, ya que la atracción nuclear es menor.
La electronegatividad de los alcalinotérreos es baja
| |
Los halógenos tienen EN alta porque tienen pocos electrones en la capa más externa.
| |
Los alcalinos son muy poco electronegativos.
| |
La electronegatividad de los gases nobles es cero.
| |