5. Cálculos estequiométricos
|
|
| Simulación 2 Proyecto TIGER, Uso educativo |
La teoría atómico-molecular supone que las sustancias están formadas por átomos, moléculas o iones. Una reacción química se produce cuando los átomos que forman las sustancias originales, llamadas reactivos se recombinan para dar lugar a unas nuevas sustancias denominadas productos. Una ecuación química es una representación simbólica de una reacción química.
También informa sobre las cantidades relativas de las sustancias que intervienen en la reacción, indicadas por los denominados coeficientes estequiométricos, números que se colocan delante de cada fórmula para indicar la cantidad de la misma. En el caso de que tengan valor unidad, se omiten.
En una ecuación química figuran dos miembros: en el primero, las fórmulas de los reactivos y en el segundo, las de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción:
n1 Reactivo1 + n2 Reactivo2 + .... → n1 Producto1 + n2 Producto2 + ....
Además, suele indicarse el estado físico en el que se encuentran las diferentes sustancias participantes, mediante unos símbolos que se colocan entre paréntesis detrás de cada una de ellas. Estos símbolos son:
- (s) ; que indica que la sustancia está en estado sólido.
- (l) ; que indica que la sustancia está en estado líquido.
- (g) ; que indica que la sustancia en estado gaseoso.
- (aq) ; que indica que la sustancia se encuentra disuelta en agua.
Se dice que una ecuación química está ajustada cuando el número de átomos de cada elemento en cada uno de los lados de la ecuación es el mismo. Es decir, hay el mismo número de átomos de cada tipo en reactivos y en productos, con lo que la masa evidentemente se conserva.
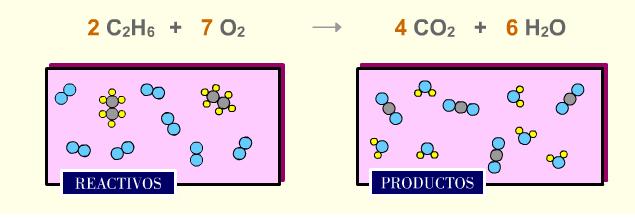
Fíjate en la reacción de combustión del etano. Comprueba que hay el mísmo número de átomos de C, H y O en reactivos y en productos.
 |
| Imagen 12 La reacción química Premio CNICE 2005, Uso educativo |
Ajustando reacciones químicas
El proceso que debes seguir para ajustar una ecuación química es el siguiente:
- Escribe la reacción en la forma : Reactivos → Productos.
- Observa los átomos de cada tipo que hay a cada lado de la reacción.
- Si hay algún tipo de átomo que no está compensado, añade el coeficiente estequiométrico correspondiente para que el número se iguale. En caso que haya más de un tipo, comienza por el que pertenezca a la partícula más compleja.
- Comprueba si la inclusión de este coeficiente ha descompensado algún otro tipo de átomo, y repite el proceso hasta que consigas que el número de átomos de cada tipo sea el mismo a ambos lados.