5.1 Interpretación de ecuaciones químicas
- A escala microscópica:
Los coeficientes de una ecuación química indican el número de partículas (átomos o moléculas) que intervienen en la reacción.
Por ejemplo, la ecuación ajustada correspondiente a la síntesis de bromuro de hidrógeno, a partir de bromo e hidrógeno gaseosos, es la siguiente:
Esta ecuación implica que 1 molécula de hidrógeno reacciona con una molécula de bromo para dar 2 moléculas de bromuro de hidrógeno. El número de moléculas de cada sustancia viene determinado por los coeficientes estequiométricos delante de las mismas.
| Reacción | H2 (g) |
+ |
Br2 (g) |
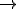 |
2 HBr (g) |
| Interpretación | 1 molécula de H2 | reacciona con |
1 molécula de Br2 |
para dar |
2 moléculas de HBr |
 |
| Imagen 13. Elaboración propia. |
Si haces clic aquí podrás acceder a una animación que te ayudará a comprender el ajuste y la interpretación de reacciones a escala microscópica.
- A escala macroscópica:
Para interpretar una ecuación a escala macroscópica debemos considerar un número elevado de moléculas, por ejemplo, el número de Avogadro (NA), donde NA = 6.023·1023. En este caso, y considerando el ejemplo anterior, en vez de 1 molécula de H2, consideraríamos NA moléculas. En este caso, la reacción se podría interpretar de la siguiente manera:
| H2 (g) |
+ |
Br2 (g) | 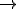 |
2 HBr (g) |
| NA moléculas de H2 | reaccionan con |
NA moléculas de Br2 |
para dar |
2·NA moléculas de HBr |
El número de Avogadro equivale al número de partículas que hay en un mol de dicha sustancia. O, dicho de otra forma, un mol de cualquier sustancia contiene 6.023·1023 partículas (que pueden ser átomos, moléculas, ...).
Por tanto, la reacción también puede interpretarse de la siguiente manera:
| H2 (g) |
+ |
Br2 (g) |
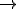 |
2 HBr (g) |
| 1 mol de H2 | reacciona con |
1 mol de Br2 |
para dar |
2 moles de HBr |
Recuerda que la masa de un mol de cualquier sustancia (masa molar) coincide numéricamente con la masa atómica o molecular de dicha sustancia. No obstante, la masa molar está expresada en g/mol mientras que la masa atómica se expresa en u (unidad de masa atómica).
Por tanto, a partir de las masas atómicas de los elementos, que vienen indicadas en la tabla periódica, puede conocerse la masa molecular (expresada en u). La masa molar es igual a la masa atómica o molecular, salvo que está expresada en g/mol.
Si miras en una tabla periódica, verás que las masas atómicas de H y Br son 1.00 u y 79.90 u, respectivamente. Por tanto, las masas moleculares de H2, Br2 y HBr son:
Mm(H2) = 2.00 u
Mm(Br2) = 159.80 u
Mm(HBr) = 80.90 u
Así, 1 mol de H2 tendrá una masa de 2.00 g; 1 mol de Br2, 159.80 g y un 1 mol de HBr, 80.90 g. De esta manera, una última interpretación de la reacción es la siguiente:
| H2 (g) |
+ |
Br2 (g) |
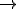 |
2 HBr (g) |
| 2.00 g de H2 | reaccionan con |
159.80 g de Br2 |
para dar |
(2· 80.90) g de HBr = 161.80 g de HBr |
En las ecuaciones químicas
La proporción de combinación en partículas que se indica en una ecuación química coincide con la proporción de combinación en cantidades de sustancia, medida en moles.