3. El estado gaseoso
Para definir el estado de un gas es necesario conocer los valores de tres de entre las cuatro magnitudes siguientes: la cantidad de gas, la temperatura a la que se encuentra, el volumen que ocupa y la presión que genera, ya que están relacionadas mediante la ecuación:
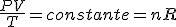
Esta ecuación ha sido obtenida mediante el estudio de las leyes experimentales de los gases. En las imágenes puedes ver lo que le sucede a un gas cuando se calienta (el globo se hincha) y cómo se interpreta utilizando el modelo de partículas de la materia (las partículas se mueven más deprisa, etc).
 |
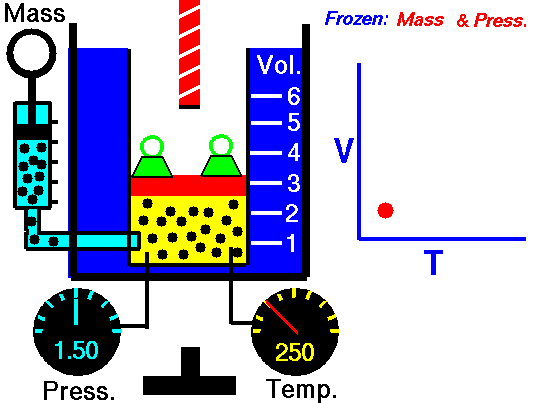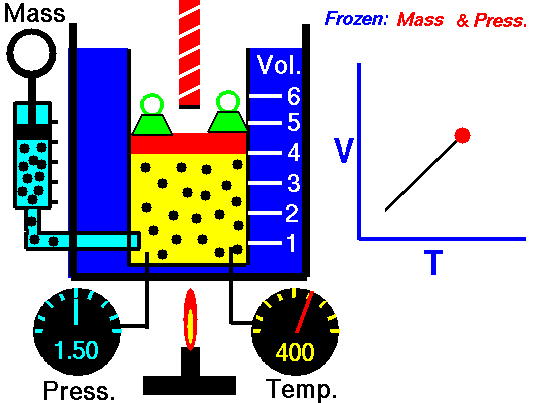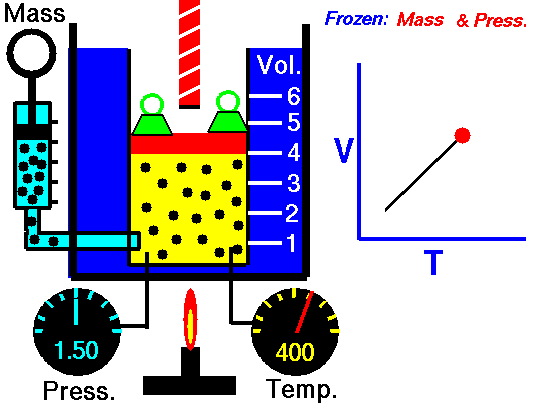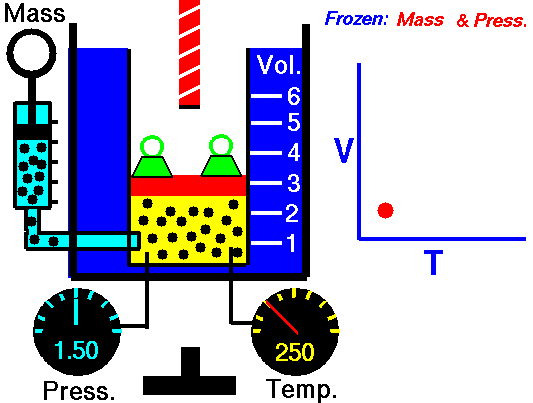 |
| Imagen 8 Elaboración propia |
Simulación 1 Nasas´s Glenn Research Center, Dominio público |
La constante de la ecuación de los gases es nR, donde n es la cantidad de sustancia de gas y R la constante de los gases, que es 8,31 J K-1 mol-1 si las unidades son las del Sistema Internacional (S.I.) -presión en pascales (Pa ó N/m2) y volumen en m3- y 0,082 atm L K-1 mol-1 si la presión se mide en atmósferas (atm) y el volumen en litros (L), que es lo más habitual. De esta forma la ecuación de los gases ideales se suele escribir como:
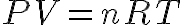
Si la cantidad de sustancia es de un mol y las condiciones son las llamadas normales (P=1 atm y T=273 K), el volumen que ocupa un mol de gas (su volumen molar) es de aproximadamente 22,4 L/mol.
Determinación de masas molares
Es muy importante porque permite identificar sustancias, ya que a cada una, con una fórmula concreta, le corresponde una masa molar: el agua es H2O y su masa molar es de 18 g/mol, mientras que el agua oxigenada es H2O2 y su masa molar es 34 g/mol.
Además de utilizando métodos específicos (espectrometría de masas, crioscopía), se pueden determinar masas molares de gases utilizando la ecuación de los gases:
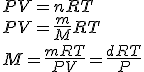
siendo d la densidad del gas (m/V).
En un recipiente de 80,2 mL se inyectan 0,179 g de un gas desconocido, de manera que a 15 ºC la presión producida por el gas es de 1,2 atmósferas. ¿De qué gas se trata entre CO, CO2, NH3 o NO2?
|
CO
| |
|
CO2
| |
|
NH3
| |
|
NO2
|