4. Composición de las disoluciones
 |
| Imagen 9 Elaboración propia |
Una disolución es una mezcla homogénea de dos o más sustancias; es decir, no se pueden distinguir las sustancias que forman la mezcla.
La sustancia que se encuentra en mayor proporción es el disolvente, agua habitualmente. La sustancia que se disuelve se llama soluto, y puede ser sólida (sal común), líquida (alcohol) o gaseosa (amoniaco).
Una disolución se dice que está diluida cuando hay una cantidad pequeña de soluto en una cantidad determinada de disolvente; si la cantidad disuelta es grande, se dice que está concentrada, y si ya no se puede disolver más sustancia, se dice que está saturada.
La composición de las disoluciones se expresa como una proporción entre la cantidad de soluto disuelta y la cantidad de disolvente utilizado o la cantidad de disolución formada.
Evidentemente, se obtienen disoluciones idénticas disolviendo 10 g de sal común en 100 mL de agua que 20 g en 200 mL, ya que la proporción es la misma, y las dos disoluciones formadas tendrán las mismas propiedades.
Gramos por litro (g/L)
Mide la masa de soluto disuelta por litro de disolvente o de disolución (m/V).
Porcentaje en masa (%)
Mide el porcentaje en masa de soluto respecto de la disolución formada. 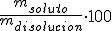
Concentración (mol/L)
La concentración se mide en moles de soluto por litro de disolución (mol/L). Esta medida tiene el nombre tradicional de molaridad (M) o concentración molar. La IUPAC aconseja no utilizar términos relacionados con molar, porque indican "por mol", y no tiene ese significado en este contexto, aunque se sigue utilizando con mucha frecuencia.
Como mide la cantidad de sustancia de soluto por litro de disolución, se determina fácilmente sabiendo la composición en g/L: para pasar la masa a cantidad de sustancia no hay más que dividir por la masa molar del soluto, M.
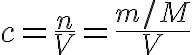
En las botellas de reactivos se suele indicar la densidad de la disolución y el porcentaje en peso de soluto. Con esos datos es sencillo determinar la composición en gramos por litro y la concentración, como puedes ver en el ejercicio resuelto siguiente.
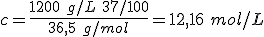
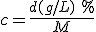 . La densidad debe estar expresada en gramos por litro, ya que la concentración se refiere a un volumen de disolución de un litro.
. La densidad debe estar expresada en gramos por litro, ya que la concentración se refiere a un volumen de disolución de un litro.