1.1 Modelo atómico de Thomson
Según Dalton, el átomo era indivisible, pero a finales del siglo XIX las observaciones empíricas ya indicaban la presencia de partículas cargadas que, por el hecho de poseer carga eléctrica, no podían ser los átomos neutros de Dalton. La conclusión lógica fue que los átomos no eran partículas fundamentales, sino que estaban formados por partículas subatómicas.
La primera de estas partículas en descubrirse fue el electrón, identificado por J.J. Thomson a partir de los resultados obtenidos en la experimentación de gases a baja presión en un dispositivo denominado tubo de rayos catódicos, que puedes observar a continuación:
|
|
| Animación 1. Iniciación Interactiva a la materia Mariano Gaite Cuesta |
Puedes observar cómo, en un tubo de rayos catódicos, al aplicar una diferencia de potencial entre los extremos (compruébalo pulsando el botón Apagar/Encender tubo) se produce la emisión de radiación en forma luminosa, transmitida en línea recta. Esta radiación fue denominada como rayos catódicos, por proceder del cátodo.
Ahora bien, al aplicar un campo eléctrico sobre la trayectoria de los rayos, se observó que estos se desviaban hacia la placa cargada positivamente, lo que indicaba claramente que dicha radiación estaba cargada, y más concretamente formada por partículas de carga negativa.
Haz la prueba pulsando en la simulación el botón Aplicar campo.
¿Por qué dedujo Thomson que los rayos catódicos estaban formados por partículas de carga negativa?
A partir del grado de desviación de los rayos en función del campo eléctrico aplicado pudo encontrar la relación entre la carga eléctrica y la masa de estas partículas, que denominó electrones:
- Su masa era
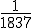 veces la masa de un átomo de hidrógeno.
veces la masa de un átomo de hidrógeno. - Su carga era
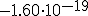 C.
C.
Dado que su masa era menor que la del átomo más pequeño y que no dependían del metal que formaba el cátodo, llegó a la conclusión de que los electrones eran partículas fundamentales, constituyentes del átomo, que a partir de entonces dejó de ser indivisible.
El electrón, representado como e- , es una partícula componente del átomo, de masa muy pequeña (9.1 ·10-31 kg) y cargado negativamente (-1.6·10-19 C). No se ha encontrado en la naturaleza una carga menor que la del electrón, por lo que su valor se toma como unidad de carga o carga elemental.
 |
| Imagen 3. Fastfission, dominio público |
Como un átomo en su conjunto es neutro, la existencia de una partícula subatómica con carga neta negativa implicaba la existencia de carga positiva en la estructura del átomo para compensar la carga de los electrones.
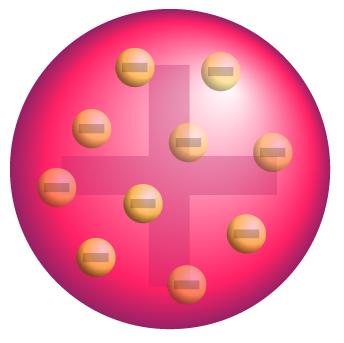
La solución que dio Thomson fue su modelo atómico, en el cual consideraba el átomo como una esfera con carga positiva uniformemente distribuida por todo su volumen y los electrones incrustados en ella como las pepitas de una sandía, tal y como puedes observar en la imagen.