2.1 Partículas subatómicas
El modelo de Rutherford incluye una novedad fundamental respecto a los modelos anteriores: el átomo deja de ser la estructura básica e indivisible de la materia. El descubrimiento del electrón demuestra que el átomo está a su vez formado por otras partículas menores, que se denominaron subatómicas. El hecho de que, en el modelo de Rutherford, la carga positiva estuviera confinada en el núcleo, llevó a postular que la carga nuclear era debida a la existencia de partículas cargadas positivamente, con igual carga que la del electrón pero de signo contrario, y con masa mucho mayor que la de éste, que se denominaron protones (p+).
 |
| Animación 2. Debianux licencia GNU |
Ahora bien, la pregunta era ¿son el electrón y el protón las únicas partículas subatómicas existentes? Si así fuera, existía un problema, ya que si los núcleos estuvieran formados por únicamente por protones serían inestables, ya que cargas del mismo signo presentan repulsión electrostática que destruiría el núcleo atómico.
En 1932 James Chadwick descubrió la existencia de una nueva partícula en el núcleo, cuya masa era prácticamente similar a la del protón, pero sin carga eléctrica, a la que denominó neutrón (n).
Estas tres partículas subatómicas constituyen el átomo según la teoría clásica y sus características principales puedes observarlas en la siguiente tabla-resumen:
| Partícula | Símbolo |
Carga Eléctrica (C) |
Masa (kg) |
Ubicación en el átomo |
| Electrón | e- |
-1.6·10-19 |
9.11·10-31 | En la corteza electrónica, alrededor del núcleo |
| Protón |
p+ |
+1.6·10-19 | 1.67·10-27 | En el núcleo |
| Neutrón |
n |
0 |
1.67·10-27 | En el núcleo |
Como resulta muy poco cómodo trabajar con números tan pequeños como los de la masa y carga de las partículas subatómicas, se han definido unidades atómicas específicas:
- Unidad elemental de carga (e): corresponde a la carga del protón (1.6·10-19 C), de modo que la carga del protón es +1 e y la del electrón -1 e, respectivamente.
- Unidad de masa atómica (u): originalmente definida como la masa de un protón (1.67·10-27kg), actualmente se define exactamente como la doceava parte de la masa de un átomo de Carbono-12. Así, la masa de un protón es de 1.0073 u, la de un neutrón 1.0087 u y la de un electrón 5.49·10-4 u. Como la diferencia es muy pequeña, a efectos prácticos se considera similar la masa del protón y del neutrón, de valor 1 u.
Completa el siguiente texto:
A pesar de que en los primeros modelos el se consideraba indivisible, distintos experimentos mostraron que estaba formado por partículas más pequeñas que se denominaron . En la teoría de Rutherford existen partículas subatómicas: el electrón, con carga y masa muy pequeña, el , cargado positivamente y el neutrón que no tiene eléctrica; estas dos últimas partículas tienen aproximadamente la masa. Mientras que los electrones se encuentran en la corteza, el protón y el neutrón se ubican en el atómico.
Actualmente sabemos que los componentes del núcleo atómico, protones y neutrones, no son partículas elementales, sino que están compuestos por otras partículas más pequeñas, denominadas quarks. Estos, junto con los leptones (el electrón es uno de ellos), son los constituyentes fundamentales de la materia.
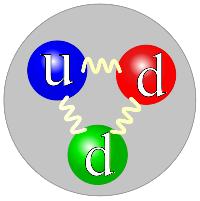 |
| Imagen 6. Arpad Horvath, Creative commons |
- up (arriba)
- down (abajo)
- charm (encantado)
- strange (extraño)
- top (cima)
- bottom (fondo).
Y por si te lo preguntas, sus nombres fueron escogidos arbitrariamente y no tienen nada que ver con sus propiedades.
Los distintos tipos de quarks se combinan de distinta manera para producir las partículas conocidas. En la imagen puedes observar un neutrón, compuesto por un quark up (u) y dos down (d)