6. Propiedades de las disoluciones
Las propiedades de las disoluciones difieren en general de las del disolvente o del soluto por separado. Nos vamos a fijar solamente en tres de ellas, pero no profundizaremos en la razón de esas propiedades. En unidades posteriores verás alguna de ellas.
 |
| Imagen 15 de elaboración propia |
Volumen de exceso
Cuando se mezclan dos líquidos, el volumen de la mezcla suele ser menor que el de los dos líquidos por separado. Por ejemplo, si se mezclan 50 mL de agua con 50 mL de etanol en una probeta de 100 mL, se observa que el volumen de la mezcla es de unos 97 mL.
Descenso crioscópico
El punto de congelación de las disoluciones acuosas es menor que el del agua.
Realiza la siguiente actividad en tu casa: pon agua del grifo en dos vasos hasta la mitad; a uno de ellos le añades sal y agitas hasta que se disuelva. Colócalos en un congelador y observa cuál se hiela antes o si se hielan ambos (dependerá de la temperatura mínima que alcance el congelador). Observarás que se congela antes el agua sin sal.
Este hecho tiene una aplicación práctica muy conocida: en invierno se echa sal en las carreteras para evitar que se formen capas de hielo. Con el mismo fin, los anticongelantes de los circuitos de refrigeración de los coches tienen etilenglicol (un tipo de alcohol) disuelto en agua.
 |
| Imagen 16 de elaboración propia |
Densidad
La densidad de las disoluciones es mayor que la del agua, ya que la densidad de los solutos también es mayor en prácticamente todos los casos.
Fíjate en la fotografía. Coloca un huevo en un vaso con agua, y verás que se hunde, ya que el agua es menos densa que él. Pero si añades sal, al disolverse aumenta la densidad de la disolución, y el huevo llega a flotar.
¿Has oído hablar de la salinidad del Mar Muerto, en Oriente Próximo? Es tan grande que se flota en él, y resulta muy difícil intentar sumergirse.
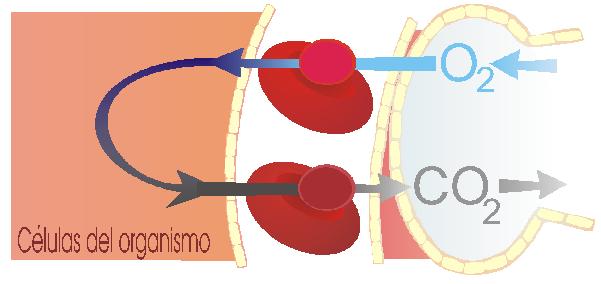
El monóxido de carbono
 |
| Imagen 17 de CNICE, uso educativo |
El oxígeno se disuelve en la sangre, sobre todo al unirse a la hemoglobina, y así se transporta desde los pulmones a las células que lo necesitan para los procesos de obtención de energía. En esos procesos se libera CO2, que es expulsado a la atmósfera desde los pulmones.
Sin embargo, hay un gas que interacciona con la hemoglobina con más facilidad que el propio oxígeno, y que al ocupar su lugar impide que llegue a las células la cantidad de oxígeno necesaria: es el monóxido de carbono, CO.
Se trata de un gas que se produce en lugares donde hay combustiones con poco oxígeno. Cada vez se forma más CO, que sustituye al oxígeno en la sangre y el ritmo vital va decayendo hasta que se produce el fallecimiento (se le llama la muerte dulce).
Todos los años se produce en España un apreciable número de accidentes de este tipo, con resultado de muerte (por mala combustión en calderas de calefacción, estufas de butano, braseros,...).