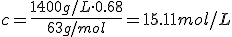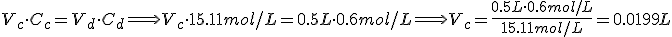4. Dilución de disoluciones
Si al cocinar un caldo te sale muy salado y lo quieres con sabor más suave ¿qué puedes hacer? Y si el color de una pintura es demasiado intenso y quieres rebajarlo ¿qué haces? Muy sencillo: añades agua, con lo que obtienes una disolución más diluida, con menor sabor o color. Ahora vas a ver cómo se realiza el proceso en el laboratorio.
En el laboratorio se dispone de HCl concentrado, aproximadamente 12 mol/L. Sin embargo, como reactivo se suele utilizar en concentraciones de 1 mol/L o menores. ¿Qué debes hacer para preparar la disolución que necesitas?
En todos los casos hay que diluir la disolución original; es decir, obtener una disolución de menor concentración que la inicial. El procedimiento es muy simple: solamente hay que tomar disolución inicial y añadirle agua. El volumen de disolución a tomar y la cantidad de agua a añadir dependen del volumen de disolución diluida que se quiera preparar, así como de su concentración.
| |
| Imagen 10 de elaboración propia |
Si te fijas en el dibujo, verás que se trata de tomar un volumen Vc de la disolución concentrada, de concentración Cc, y añadir un volumen de agua, Vagua (es decir, Cc>Cd). El volumen de la disolución diluida es la suma de los volúmenes mezclados (Vd=Vc+Vagua).
Pero la cantidad de sustancia de soluto en el volumen Vc de disolución concentrada es la misma que en el volumen Vd de disolución diluida, ya que se añade solamente agua; es decir, nc=nd. Escribiendo las cantidades de sustancia en función de la concentración y del volumen, se tiene la expresión final, que es la que se utiliza habitualmente en los cálculos:
|
|
| Video 2 de Freephysique, uso libre |
Cc.Vc=Cd.Vd
Fíjate en que sabrás tres de las cuatro magnitudes y calcularás la que te falte.
En el siguiente video puedes observar el procedimiento que se sigue para preparar un volumen determinado de una disolución utilizando otra más concentrada.
En primer lugar, debes hacer los cálculos oportunos para saber el volumen de disolución concentrada que necesitas. Ese volumen lo añadirás a un matraz aforado y completarás con agua como ya has visto antes.
En este caso, se diluye una disolución desatascadora (NaOH concentrado), de la que se toman 5 mL y se llevan hasta 100 mL, con lo que el volumen aumenta 20 veces, y la concentración, por tanto, disminuye otras 20 veces.
El ácido nítrico concentrado (HNO3) es del 68% en masa y de densidad 1.40 g/mL. Indica el procedimiento para preparar 500 mL de HNO3 0.6 mol/L.
Observa la imagen correspondiente a la misma sustancia disuelta en diferentes recipientes. Justifica el orden de concentraciones en ellos. ¿Cómo se diluye de una a otra?
 |
| Imagen 11 de AMarkov, Creative commons |