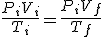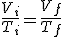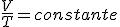1.5 Síntesis de las leyes
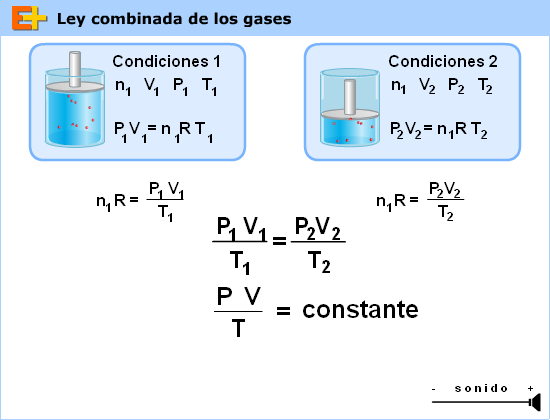
Las tres leyes referidas a un único gas (Boyle, Charles y Gay-Lussac) se pueden resumir en una única ecuación matemática:
| Simulación 1 de Jesús Peñas, licencia Creative Commons |
PV/T=cte (que depende de la cantidad de gas)
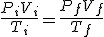
Fíjate
en que si mantienes constante la temperatura T, la ecuación general se reduce a
PV=cte, ya que al ser Ti = Tf puedes simplificar la igualdad. Es decir, se obtiene la ley de Boyle. Evidentemente, la constante de esta ley de Boyle es distinta de la anterior.
De forma similar, manteniendo constante la presión o el volumen, obtendrás las leyes de Charles y de Gay-Lussac.
Es importante que te fijes en que las constantes de las leyes dependen de la cantidad de gas que hay en el recipiente y su valor es diferente en cada ley.
Deduce la ley de Charles utilizando la ecuación general de los gases.