1.4 Ley de Dalton
En 1803, Dalton enunció una ley referida a las mezclas de gases: cuando hay varios gases en un mismo recipiente, la presión total producida por la mezcla es la suma de las presiones que cada uno de los gases generaría si estuviera solo en el recipiente. Es decir, la presión total es la suma de las presiones parciales.
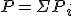
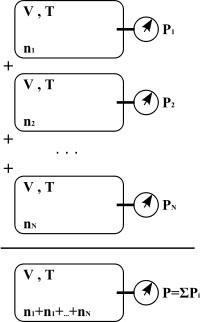
Cuando hay varios gases en un recipiente, se encuentran formando una mezcla homogénea, y no es posible diferenciar unos de otros, pero se comportan como si cada uno de ellos estuviera solo en el recipiente.
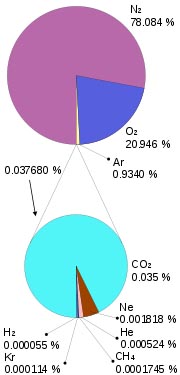
Es el caso del aire, que tiene casi un 80% en volumen de nitrógeno y casi un 20% de oxígeno, junto a porcentajes muy pequeños de dióxido de carbono, vapor de agua, gases nobles, etc.
 |
 |
| Imagen 8 de Mysid, Creative commons |
Imagen 9 de Mintz, dominio público |