4. Enlaces químicos en la vida
Los átomos de diferentes elementos químicos pueden reaccionar unos con otros para dar lugar a nuevas sustancias llamadas compuestos. Al combinarse forman una sustancia que presenta propiedades fisicoquímicas distintas de los elementos originales.
Recuerdo un caso que escuché que me llamó mucho la atención. El sodio
es un metal blando de color plateado que en contacto con el agua se
inflama, formando llamas amarillas. El cloro, es un elemento que en
estado puro aparece en forma de gas de color verdoso, precisamente de
ahí viene su nombre, tiene olor desagradable y es muy tóxico, tanto que
este gas fue usado como un arma química en la Primera Guerra Mundial.
Cuando estos elementos reaccionan, forman un compuesto totalmente
inocuo, el cloruro de sodio: ¡la sal!
Tenía tanta curiosidad que he buscado y encontrado este vídeo del experimento (está en inglés, pero se entiende bien):
La unión entre átomos, moléculas o iones —los iones son átomos o
moléculas con carga eléctrica; si esta carga es positiva se les llama
catión, mientras que si tienen carga eléctrica negativa se les llama
anión—, se realiza por uniones llamadas enlaces químicos, que dan estabilidad a los compuestos químicos.
En un enlace químico, los elementos se encuentran más estables que por separado ya que disminuyen su energía.
Esta situación de mayor estabilidad suele darse cuando el número de
electrones que poseen los átomos en su último nivel es igual a ocho,
estructura que coincide con la de los gases nobles, y para conseguirla
los átomos ganan, pierden o comparten electrones. Este principio recibe
el nombre de regla del octeto.
Este vídeo explica, con imágenes, la regla del octeto. Esta regla nos
servirá para predecir qué tipos de átomos se combinaran y cómo lo harán.
Bueno, ya sé lo que es un enlace químico, pero...
¿Para qué se unen los átomos?
¿Qué es para un átomo la estabilidad?
¿Cómo consigue un átomo la configuración de gas noble?
Para representar los enlaces entre los átomos de una molécula y los pares de electrones que no están unidos se utiliza la representación de Lewis. En esta representación se muestran los átomos de una molécula con su símbolo químico y líneas —o pares de puntos— que se trazan entre los átomos que se unen entre sí.
Mira esta representación de la molécula de oxígeno:
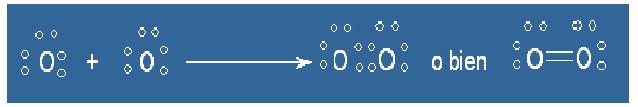 |
| Imagen de elaboración propia. |
Si quieres comprobar lo que estas aprendiendo sobre la configuración de Lewis puedes realizar estos ejercicios.