3. Velocidad de las reacciones químicas
 |
 |
| Animación 2. Proyecto Ulloa, uso educativo |
Animación 3. Proyecto Ulloa, uso educativo |
Una de las características de las reacciones químicas más espectaculares es que ocurren con extrema rapidez, como sucede en las explosiones o la combustión al encender una cerilla. Sin embargo, la oxidación de los metales a la intemperie es tan lenta que sus efectos no son perceptibles hasta meses o años después de haber comenzado.
Es evidente que es posible comparar la velocidad de estas reacciones, pero ¿cómo medirla?
La forma habitual en el trabajo de laboratorio es definir la velocidad de reacción de la siguiente forma:
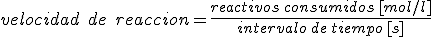
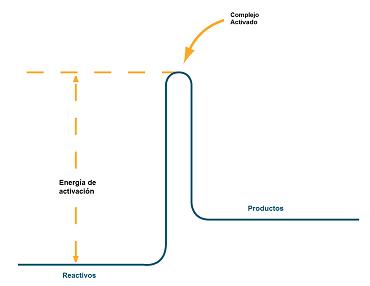 |
| Imagen 9. Adaptación de la NIGMS, dominio público |
Se denomina energía de activación a la energía cinética mínima que deben tener los átomos o moléculas de los reactivos para que reaccionen.
El hecho de que una reacción química tenga o no lugar no depende únicamente del valor de la energía de activación, sino que es necesario que se cumplan simultáneamente estas dos condiciones:
- Que la energía cinética de los átomos o moléculas reaccionantes sea mayor que la energía de activación.
- Que la orientación de los átomos moléculas en el choque sea la adecuada y permita la formación de los productos.
Cuando se cumplen estas dos condiciones se dice que ha tenido lugar una colisión eficaz, se forma el denominado complejo activado, en el que se están rompiendo enlaces en reactivos y formándose enlaces en productos, y la reacción tiene lugar.