3.1 ¿De qué depende la velocidad de reacción?
Como ya has visto, para que una reacción química tenga lugar es necesario que se produzcan colisiones eficaces. Por lo tanto, para aumentar la velocidad de reacción será necesario aumentar el número de colisiones eficaces por unidad de tiempo (ten en cuenta que el razonamiento es el mismo, pero al contrario, para disminuir la velocidad de reacción), lo cual puede lograrse de diferentes maneras:
1. Variando la temperatura
Observa el vídeo adjunto, en el que se muestra la reacción de una pastilla efervescente en dos vasos, uno con agua fría y otro con agua caliente ¿Qué conclusión obtienes?
La pastilla reacciona mucho más rápido en el agua caliente; esto se debe a que, como sabes, la temperatura es una medida de la energía cinética media de las partículas, por lo que al aumentar la temperatura las partículas de los reactivos chocan más veces y, por tener más energía, hay mayor número de partículas que superan la energía de activación, lo que da lugar a más colisiones efectivas y una velocidad de reacción mayor.
|
|
 |
| Video 2. FQManuel, uso libre | Imagen 10. Elaboración propia |
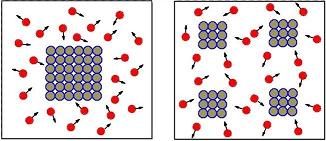
2. Influencia del grado de pulverización
En el caso que los reactivos estén en estado sólido, la superficie de contacto es un factor muy importante a la hora de aumentar la velocidad de reacción, por facilitar el contacto de los reactivos y, con ello, la colisión entre las partículas.
Por esta razón, lo preferible es disolver los reactivos y, cuando esto no es posible, proceder a su pulverización, esto es, la reducción a partículas lo más pequeñas posibles.
3. Concentración de los reactivos
Al aumentar la concentración de los reactivos aumenta el número de colisiones entre ellos, por haber un mayor número de partículas en el mismo volumen, y por ello también aumenta la velocidad de reacción.
La velocidad de una reacción química aumenta al aumentar:
- La temperatura.
- La superficie de contacto (grado de división).
- La concentración de los reactivos.
Es una forma alternativa de aumentar la velocidad de reacción: disminuyendo la energía de activación se consigue que un mayor número de partículas la superen y puedan dar lugar a productos de reacción. Esto se consigue mediante unas sustancias denominadas catalizadores a las que, debido a su importancia, dedicaremos el siguiente apartado.
 |
| Imagen 11. Marcus Brunner. GNU Free License |
El magnesio es un metal se utiliza para producir, aleado con el aluminio, latas de refresco. También tiene uso industrial en piezas de aviones y de vehículos de competición, e incluso en la fabricación de sacapuntas de lapicero.
Sin embargo, el magnesio es extremadamente inflamable, especialmente si está pulverizado. En contacto con el aire y algo de calor no muy fuerte reacciona rápidamente, por lo que debe manipularse con precaución, utilizándose en flashes fotográficos y pirotecnia.
¿Cómo explicas esta diferencia de comportamiento del magnesio?