3.2 Catalizadores
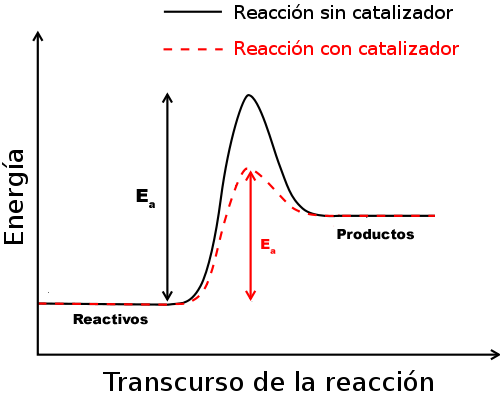 |
| Imagen 12. Elaboración propia |
El efecto de un catalizador es similar al de un túnel a baja cota que evita el paso por un puerto de montaña, pues permite la conversión de los reactivos a productos por un camino de menor energía, aumentando la velocidad del proceso al no ser necesario tanto tiempo en realizarlo.
Es importante recordar que un catalizador no forma parte de la reacción propiamente dicha, ya que se recupera en su totalidad al final de la misma: no se trata ni de un reactivo ni de un producto, sino únicamente de un "mediador" que acelera la reacción al disminuir la energía de activación.
Las enzimas
 |
| Imagen 13. Aza Toth, dominio público |
Las enzimas son proteínas que catalizan reacciones químicas en los seres vivos. Las enzimas actúan sobre unas moléculas denominadas sustratos, modificándolos hasta que dan lugar a su conversión en productos diferentes, denominándose el proceso "reacción enzimática".
Casi todos los procesos celulares precisan la presencia de enzimas para ocurrir en tasas significativas, ya que la temperatura a la que se realizan (unos 37 ºC en el caso del hombre) es baja. Además, las enzimas son muy selectivas con sus sustratos, de forma que cada una de ellas únicamente es válida para un proceso específico.
El funcionamiento de las enzimas es similar al del resto de catalizadores, disminuyendo la energía de activación del proceso y aumentando la velocidad de reacción, sin alterar el proceso.
A veces no se desea aumentar la velocidad de reacción, sino disminuirla. Este es el caso de la conservación de los alimentos.
Los alimentos se echan a perder por la acción de bacterias y microorganismos y también por la exposición al oxígeno atmosférico, lo cual da lugar a un proceso de oxidación. Una forma de evitarlo es disminuir la temperatura (frigoríficos y congeladores), pero cada vez más se hace uso de productos químicos denominados inhibidores, que reducen la velocidad de reacción.
Los conservantes alimentarios como el ácido sórbico (E200) o el ácido benzoico son inhibidores de las reacciones que degradan los alimentos, y son de uso habitual en la industria alimentaria.
El agua oxigenada (H2O2) se utiliza como desinfectante sanitario, además de como decolorante. En condiciones normales se descompone dando lugar a oxígeno (O2) y agua (H2O). Este proceso es tan lento que no resulta apreciable.
Sin embargo, cuando se pone en contacto con una herida, el proceso se acelera de forma evidente, formando una espuma blanquecina de la que escapan las burbujas de oxígeno.
¿Se te ocurre alguna razón que explique este aumento de la velocidad de reacción?