4. Energía en las reacciones químicas
Hay muchas reacciones químicas que cuando se producen originan una elevación de temperatura del recipiente de reacción. Reciben el nombre de exotérmicas. El ejemplo más conocido son las combustiones. ¿Cuál es el origen de esa energía liberada al producirse la reacción?
Fíjate otra vez en la animación sobre la síntesis del agua, y observa cómo se rompen las uniones antre átomos de oxígeno por un lado y de hidrógeno por otro, y cómo se forman uniones entre átomos de hidrógeno y de oxígeno para formarse agua.
En una transformación química se rompen algunos enlaces de los reactivos y se forman otros nuevos para dar lugar a los productos. Esa energía que hay que comunicar para romper las uniones entre átomos se denomina energía de enlace. La energía de enlace es una medida de la energía química de las sustancias.
Naturalmente, si para separar átomos (romper enlaces) hay que comuncar energía, cuando los átomos se unen (formar enlaces), se desprende energía. Según cuántos sean y la intensidad de los enlaces rotos y formados, en conjunto habrá que comunicar energía para que la reacción se produzca, o bien se deprenderá energía: el proceso será endotérmico o exotérmico.
Desde el punto de vista energético hay dos tipos de reacciones químicas:
- Reacciones exotérmicas: cuando la energía química de los productos es menor que la de los reactivos y este exceso se manifiesta como una liberación de energía.
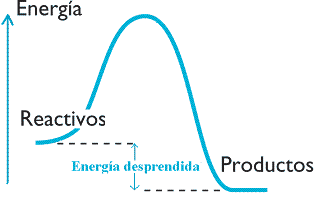 |
| Imagen 14. Elaboración propia |
- Reacciones endotérmicas: cuando la energía química de los productos es mayor que la de los reactivos, y es necesaria una aportación energética externa para que la reacción tenga lugar.
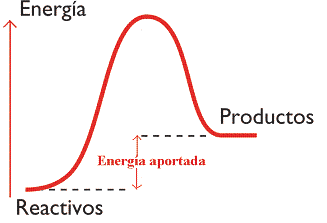 |
| Imagen 15. Elaboración propia |
Bebidas autocalentables
 |
| Imagen 16. Rincón de la ciencia, uso educativo |
En los últimos años han aparecido en el mercado cafés, chocolates o sopas que se calientan de forma automática sin necesidad de utilizar una fuente externa de energía. Estos recipientes autocalentables presentan una doble cámara, rodeando casi en su totalidad una a la otra.
La cámara interior contiene la bebida, mientras que la exterior contiene sustancias químicas que, al mezclarse dan lugar a una reacción exotérmica. Cuando el usuario quiere calentar el contenido del recipiente, tira de una pestaña del mismo, provocando la ruptura de la barrera de separación de los reactivos en la cámara exterior. El calor emitido por la reacción se transmite a la cámara interior, calentando la bebida.
Estos dispositivos son muy útiles para excursionistas o personas sin acceso inmediato a lugares en los que tomar algo caliente, pero presenta problemas tanto económicos (son sensiblemente más caros que las bebidas convencionales) como técnicos (el calentamiento no resulta ser del todo homogéneo).
Verdadero Falso
Verdadero Falso
Verdadero Falso