6. Aplicaciones en el entorno
1. Protección de monumentos de mármol
 |
| Imagen 6 Alexander, Creative commons |
Los monumentos levantados en Grecia y Roma han pervivido hasta 2000 e incluso más años sin más daños que los ocasionados por la incultura, así como por el mero aprovechamiento de los materiales como elementos de construcción.
Sin embargo, en los últimos 50 años los daños se han acelerado notablemente debido a un efecto potenciado por la actividad humana: la lluvia ácida.
El azufre que contienen muchos combustibles produce SO3, que con el vapor de agua atmosférico da lugar a H2SO4, es decir, a lluvia ácida.
Cuando llueve, el CaCO3 que forma el mármol se transforma en CaSO4 en la superficie del monumento, y como el sulfato de calcio es más soluble que el carbonato, el efecto de la lluvia es mayor, y el monumento se deteriora más deprisa.
En muchos monumentos de mármol se hace un tratamiento con Ba(OH)2 y urea, de forma que la superfice del monumento queda recubierta por una fina capa de BaCO3, sólido con el mismo aspecto que el mármol y prácticamente la misma solubilidad. Sin embargo, por efecto de la lluvia ácida se transforma en BaSO4, que tiene una constante de solubilidad de 1,1 10-10, mientras que la del CaSO4 que se forma sin el tratamiento es de 9,1 10-6. Es decir, con este tratamiento ¡la lluvia ácida contribuye a proteger el mármol!
2. Eliminación de la dureza de las aguas
 |
| Imagen 7 Alkyd Uso libre |
¿Qué significa que un agua es dura? Se trata de agua con un alto contenido en sales, sobre todo de calcio. Se suele considerar dura un agua que tiene disueltos más de 120 mg/L de CaCO3.
Se trata de aguas que producen poca espuma con los detergentes, y que en el caso de las aguas minerales suelen tener depósitos blanquecinos en el fondo de la botella.
¿Cómo se puede evitar la formación de sales cálcicas, o bien disolverlas cuando ya se han formado? Una solución es añadir EDTA, una sustancia que forma un complejo muy estable con los iones calcio. Es decir, si hay carbonato de calcio sólido se establece el equilibrio:
CaCO3 (s) ↔ Ca2+ (aq) + CO32- (aq)
Al añadir EDTA, se une a los iones Ca2+, formando un compuesto complejo soluble. Como la cantidad de Ca2+ disminuye, el equilibrio de solubilidad se desplaza a la derecha para producirlo, redisolviéndose el precipitado.
Fíjate en las etiquetas de los suavizantes que se utilizan al lavar la ropa: suelen tener EDTA para evitar la precipitación de sales cálcicas y que las fibras de la ropa se queden rígidas y "rasquen".
 |
| Simulación 6 ADuran Creative commons |
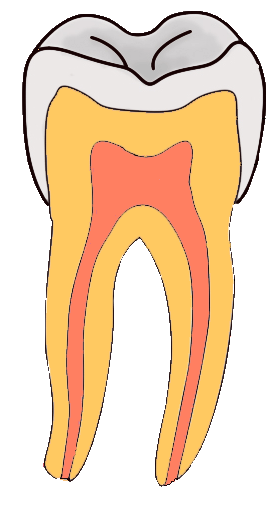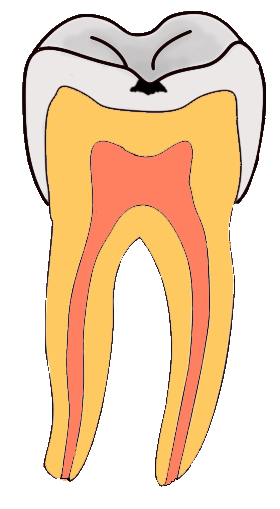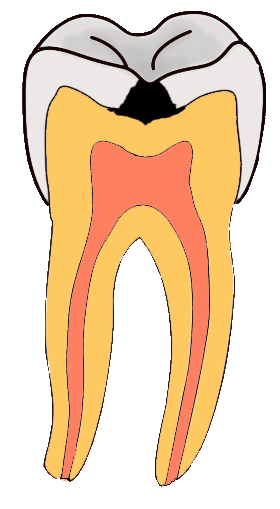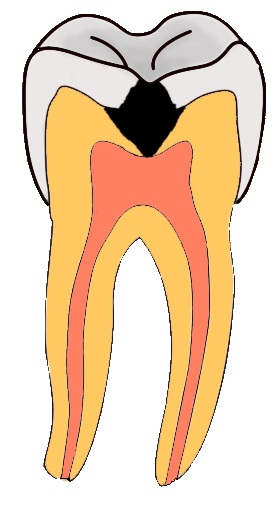
3. Caries dental
La caries consiste en el debilitamiento y posterior rotura de la dura capa exterior de las piezas dentales. Para evitar la formación de caries, es necesaria una adecuada higiene bucal, que se suele complementar con tratamientos protectores a base de flúor (administración directa de iones fluoruro o pastas dentífricas que tienen iones fluoruro).
El esmalte dental es hidroxiapatito, de fórmula Ca10(PO4)6(OH)2, que por acción de los ácidos se disuelve, dando lugar a caries. La administración de fluoruro produce la sustitución de los iones OH- por iones F-, dando lugar a fluorapatito, Ca10(PO4)6F2, más insoluble que el hidroxiapatito y más resistente a la acción de los ácidos.
En la imagen puedes ver cómo la perforación del esmalte de la parte superior de una muela llega hasta la materia blanda interior, en la que están las raíces nerviosas que al quedar sin protección provocan un dolor intenso, sobre todo frente a cambios de temperatura.
Ca10(PO4)6(OH)2 (s) « 10 Ca2