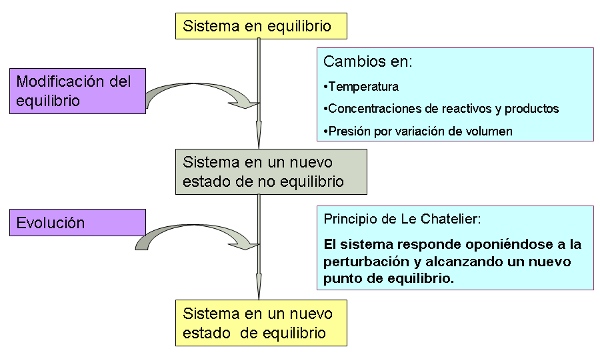
2. Alterando el estado de equilibrio
Una vez que un sistema ha alcanzado el estado de equilibrio (Q = K), su composición ya no cambia mientras no haya acciones externas. Se comprueba experimentalmente que hay diferentes formas de alterar la situación de equilibrio de un sistema mediante acciones externas: añadiendo o quitando sustancias que intervienen en el equilibrio, cambiando el volumen del recipiente que contiene al sistema y calentando o enfriando.
Naturalmente, el sistema deja de estar en equilibrio (Q ≠ K), por lo que debe evolucionar para alcanzar un nuevo estado de equilibrio. ¿Cómo lo hace para llegar a esa situación?
La primera explicación la dió Le Chatelier en 1884, atendiendo a observaciones puramente experimentales que no tenían ninguna justificación teórica, pero que permitían hacer predicciones correctas. Actualmente se sigue utilizando el principio de Le Chatelier, pero, como vas a ver, no es la única forma de explicar lo que sucede, y, además, las predicciones que hace en algunos casos son incorrectas.
 |
| Imagen 3 Elaboración propia |
De una forma simplificada, se puede decir que:
Cuando sobre un sistema en equilibrio se realiza una acción externa que lo perturba rompiendo el estado de equilibrio, el sistema evoluciona para alcanzar un nuevo estado de equilibrio, oponiéndose a la acción externa para que la perturbación sea menor de la esperada.
Es decir, si hay n moles de una sustancia A que está en equilibrio y se añaden x moles, se rompe el estado de equilibrio y se alcanza uno nuevo, en el que de la sustancia A hay una cantidad menor de n+x, que era la cantidad esperada: se reduce el efecto de la perturbación exterior.
Para explicar situaciones concretas, podrás hacer uso del principio de Le Chatelier, o bien compararás el cociente de reacción con la constante de equilibrio.