2.1 Números cuánticos
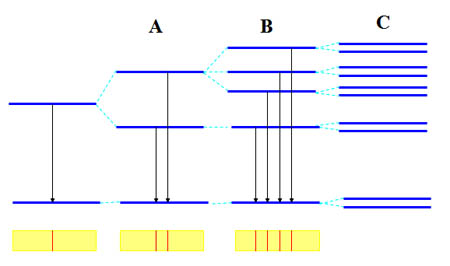
Al ir mejorando la calidad de los espectroscopios utilizados, se observó que algunas de ellas en realidad estaban formadas por dos líneas muy juntas. Es decir, donde había una única transición entre niveles energéticos, en realidad había dos, lo que significa que no había un único nivel energético inicial, sino dos de energía muy parecida (A en la imagen).
 |
| Imagen 10 Elaboración propia |
Para explicar este hecho experimental, Sommerfeld completó el modelo de Bohr, proponiendo que los electrones podían moverse en órbitas elípticas, además de en circulares. Para ello, tuvo que introducir un número relacionado con la excentricidad de la elipse, l o número cuántico secundario, que toma valores entre 0 y n-1.
De esta forma, si n=2, puede haber dos órbitas, con l=0 o con l=1: precisamente los dos niveles de origen en las transiciones energéticas hasta la órbita con n=1.
Además, al realizar los espectros bajo la influencia de un campo magnético se observaba otro desdoblamiento de líneas en tres, cinco o siete (efecto Zeeman). Luego en origen hay tres, cinco o siete niveles energéticos donde solamente hay uno sin campo magnético.
Es necesario un nuevo número cuántico para dar cabida a este hecho: el número cuántico magnético m, que depende del valor de l, y toma valores entre -l y +l pasando por 0. Está relacionado con la orientación espacial de las órbitas.
Fíjate en la imagen: la parte A corresponde al espectro de emisión sin campo magnético, mientras que la parte derecha se ha realizado con campo magnético. Donde hay tres niveles con la misma energía (se llaman degenerados), se desdoblan en tres niveles de energía diferente, que dan lugar a tres líneas espectrales. Como las energías de esos niveles es muy parecida, las tres diferencias de energías también lo son, y las tres líneas espectrales están muy juntas en el registro espectral.
Por último, observa en C que todos los niveles se desdoblan en dos. Este hecho está relacionado con una propiedad del electrón llamada spin.
La situación y energía del electrón en el átomo de hidrógeno viene determinada por tres números cuánticos:
n, número cuántico principal, que toma valores enteros 1, 2, 3, ...
l, número cuántico secundario, que para cada valor de n toma valores desde 0 hasta n-1.
m, número cuántico magnético, que para cada valor de l toma valores -l, ..., 0, ..., +l.