5. Configuraciones electrónicas
El átomo de hidrógeno tiene un único electrón. ¿Qué orbital describirá su situación en el átomo? ¿Qué sucederá en el caso del helio, que tiene dos electrones? Y al continuar el proceso, pasando de un elemento químico al siguiente, que tiene un electrón más, ¿cómo se van modificando las estructuras electrónicas?
En primer lugar, se sigue el principio de mínima energía. El estado fundamental de un átomo es el de menor energía, aquél en que los electrones están en los orbitales de menor energía posible. Si un átomo absorbe energía, el electrón más externo, que está más débilmente ligado al núcleo, pasa a un orbital de mayor energía; se trata de un estado excitado.
El conjunto de orbitales que tienen energías parecidas se llama capa. Cada capa se caracteriza por el número cuántico principal n de los orbitales que la forman.
¿Cuál es la secuencia de energía de los diferentes orbitales? Para recordarla hay varias reglas, pero lo más fácil es utilizar la tabla periódica. En el tema siguiente aprenderás a hacerlo.
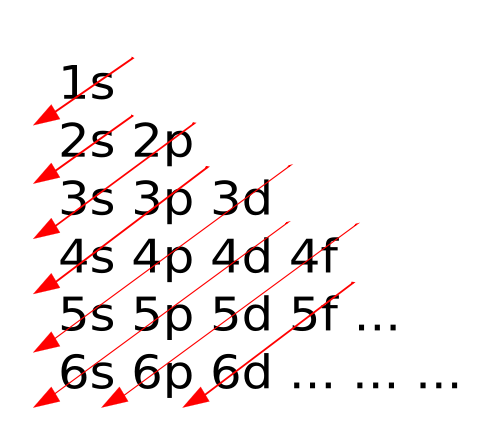
En la imagen de la derecha puedes ver el diagrama de Möeller, que indica la secuencia de ocupación de orbitales, en el orden que marca la flecha:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d ....
De momento, fíjate en la secuencia de niveles de energía. El orbital 4s tiene menor energía que el 3d, y por esa razón se colocan en él los electrones antes que en el 3d. Alteraciones de ese tipo se producen despúes: tras el 4p se rellenar el 5s, luego el 4d, etc. Se debe a las interacciones entre todos los electrones que hay en los átomos polielectrónicos.
|
 |
| Imagen 18 Elaboración propia |
Imagen 19 Sharayanan, Creative commons |
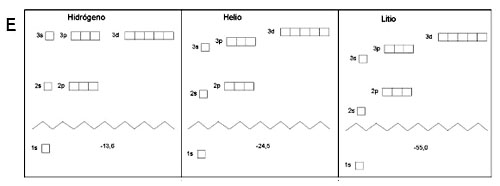
La diferencia de energía entre capas electrónicas va disminuyendo: de la primera a la segunda es muy grande, pero se hace menor de la segunda a la tercera, todavía menor de la tercera a la cuarta, etc
Además, la energía de los niveles va siendo menor conforme aumenta el número atómico del elemento, ya que hay más protones en el núcleo para atraer los electrones (la energía del orbital 12 del H es de -13.5 eV,mientras que la del mismo orbital dle litio es -55 eV. También cambian las diferencias energéticas entre niveles, lo que permite explicar que las transiciones energéticas, y, por tanto los espectros, sean diferentes para cada elemento químico.