1.1 Espectros atómicos
 |
| Imagen 6 Alchemist-hp, Creative commons |
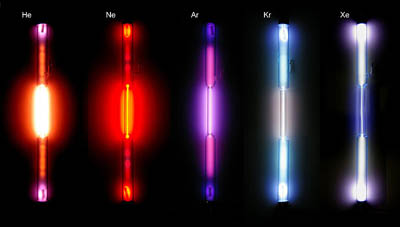
Uno de los avances fundamentales en el conocimiento de la estructura atómica vino originado por el trabajo de los espectroscopistas, que durante la segunda mitad de siglo XIX se dedicaron a recoger las impresiones fotográficas que dejaba la radiación (habitualmente luz) emitida por los diferentes elementos químicos conocidos. Esos registros se conocen con el nombre de espectros. Para obtenerlos, se comunicaba una gran cantidad de energía a la sustancia, mediante calor o chispa eléctrica, y utilizando un espectroscopio se analizaba y registraba la radiación emitida.
Cuando se calienta sodio o una sal de sodio a la llama, se emite un luz amarillo-naranja muy intensa. En otros casos, la luz es verde, o de otros colores. Y en otras ocasiones, la radiación emitida no es visible por el ojo humano.
La energía de la radiación emitida viene dada por la expresión 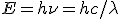 , donde h es la constante de Planck, E es la energía (J),
, donde h es la constante de Planck, E es la energía (J), 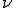 es la frecuencia (Hz),
es la frecuencia (Hz), 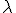 es la longitud de onda (m) y c la velocidad de la luz (3 108 m/s).
es la longitud de onda (m) y c la velocidad de la luz (3 108 m/s).
De esta ecuación se deduce que la energía de una radiación electromagnética es directamente proporcional a la frecuencia e inversamente proporcional a la longitud de onda. La radiación infrarroja es de menor frecuencia que la visible, y ésta menor que la ultravioleta y los rayos X. De ahí que los rayos X sean más nocivos para la salud que la radiación infrarroja o la luz emitida por una bombilla.
 |
| Imagen 7 Jkasd, Creative commons |
En el caso de la luz, el espectro es continuo, con radiaciones de todas las frecuencias. Pero al calentar un elemento gaseoso hasta que llega a la incandescencia, se produce una emisión de luz que, al hacerla pasar por un prisma, se descompone en forma de un espectro discontinuo, que consta de una serie de líneas correspondientes a determinadas frecuencias y longitudes de onda.
A este tipo de espectros se los conoce como espectros de emisión, y tienen la característica fundamental que cada elemento químico presenta un espectro característico propio, específico y diferente de los del resto de elementos, que sirve como "huella digital" permitiendo identificarlo fácilmente. De esa forma se descubrió el helio, identificando un elemento desconocido al realizar el análisis espectral de la radiación solar durante un eclipse de sol en 1868.
La ecuación de Rydberg
|
|
| Vídeo 1 Fisikvideos, Uso libre |
El espectro más sencillo y estudiado es el del hidrógeno. Las líneas que aparecen en la imagen corresponden a la zona visible, y forman la llamada serie de Balmer. Hay otra serie en la zona ultravioleta, más energética (serie de Lyman) y tres más en el infrarrojo (series de Paschen, Brackett y Pfund).
Analizando las longitudes de onda de las radiaciones emitidas, Balmer obtuvo en 1885 una ecuación puramente experimental que permitía reproducir las líneas correspondientes a las cinco series, en la que R es la constante de Rydberg (1,097 107 m-1).
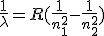
Para la serie de Lyman, n1=1 y n2=2,3,4,5,.....Para las de Balmer, Paschen, Brackett y Pfund, n1 es 2, 3, 4 ó 5, respectivamente, y n2 es un número entero mayor que n1.
En el vídeo puedes ver el espectro del helio. Este elemento se descubrió analizando espectros de la radiación solar; pocos años después, se encontró en la Tierra. Fíjate en las líneas de colores que se observan, correspondientes a la zona visible de la radiación electromagnética.
 |
| Imagen 8 IES Aguilar y Cano, Uso educativo |
En el sitio web del IES Aguilar y Cano (¡hacen un magnífico trabajo!) puedes revisar los contenidos relacionados con la estructura atómica desarrollados en la Fisica y Química de 1º de Bachillerato, así como aclarar y completar otros sobre los espectros atómicos, el modelo de Bohr y la mecánica cuántica ondulatoria, que verás más adelante.
Se trata de una serie de animaciones flash, por las que navegarás sin más que pulsar los botones de avance o retroceso.
Para ver las simulaciones relacionadas con el modelo de Bohr o con la mecánica cuántica, no tienes más que pulsar los apartados del menú de la izquierda.
Utilízalas para visualizar los fenómenos que se explican en este tema, así como los conceptos implicados, que son muy abstractos y no resultan fáciles de comprender.