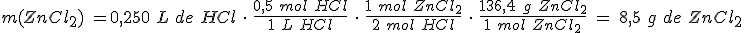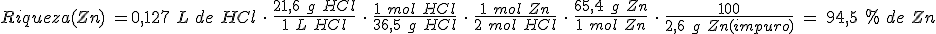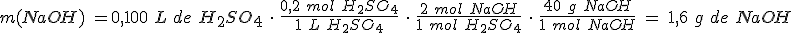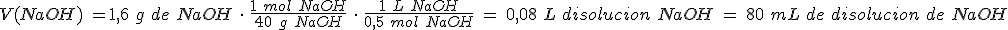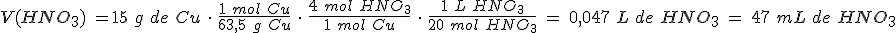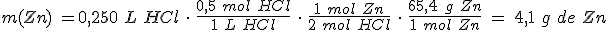3. Las disoluciones en las reacciones químicas
Gran cantidad de reacciones químicas se producen en disolución acuosa. En este caso, los datos o las incógnitas se expresan en forma de volúmenes de disolución. La secuencia de operaciones incluirá un factor que tenga en cuenta la relación entre el volumen de disolución y la cantidad de sustancia de soluto.
 |
| Imagen 9. Isftic, uso educativo |
a) Si la forma de expresar la composición de la disolución es la concentración ( c = nsoluto(mol) / Vdisolución (L)), el factor de conversión es:
n = c · V
b) Si la composición se expresa en concentración en masa ( ç = msoluto(g)/ Vdisolución(L)), el factor de conversión es:
n = m / M = ç ·V / M , con M la masa molar.
c) Si la composición de la disolución se expresa de otra forma, se pasa a concentración y se utiliza el factor de conversión indicado.
Por ejemplo, si se expresa en % en masa (% en masa = msoluto/mdisolución . 100) y nos dan la densidad de la disolución (ddisolución = mdisolución/Vdisolución), calcularemos la concentración como sigue:
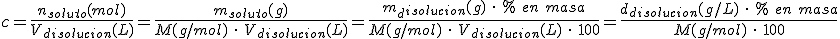
y, una vez hallada c procederemos como en el apartado a).
 |
| Imagen 10. Walkerma, dominio público |
En un vaso de precipitados tienes 4,1 g de cinc y les añades 250 mL de una disolución de ácido clorhídrico de concentración 0,5 mol/L. ¿Qué masa de cloruro de cinc se formará? En la reacción se produce también dihidrógeno.
 |
| Imagen 11. Walkerma, dominio público |
 |
| Imagen 12. Walkerma, dominio público |
Si el hidróxido de sodio lo tienes en una disolución de concentración 0,5 mol/L, ¿qué volumen de la misma habrá sido necesario para la neutralización anterior?
 |
| Imagen 13. Fabexplosive. Creative commons |