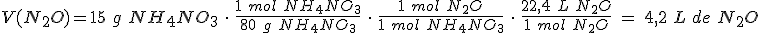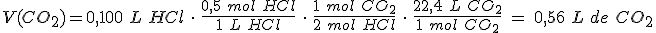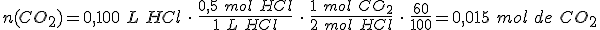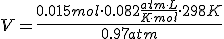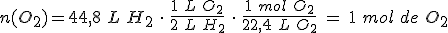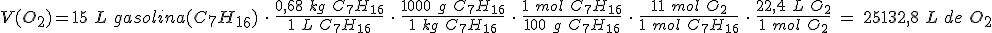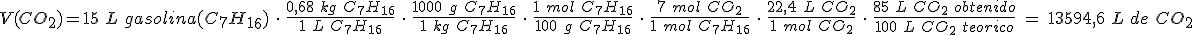4. Reacciones químicas con gases
| Imagen 14. Bancoimagenes.isftic, uso educativo |
Cuando intervienen gases en las reacciones químicas, los datos y los resultados suelen expresarse en volumen de gas, en unas condiciones determinadas de presión y temperatura.
Cuando en una reacción química todas las sustancias que intervienen son gases, en las mismas condiciones de presión y temperatura, los coeficientes estequiométricos también indican la relación de volúmenes entre las sustancias que reaccionan. Esto es debido a que, de acuerdo con la ley de Avogadro, un mol de un gas ocupa el mismo volumen que un mol de otro gas, en las mismas condiciones de presión y temperatura: hay el mismo número de partículas en ambos casos.
| |
| Imagen 15. JGvBerkel, dominio público |
Dispones de 1 litro (L) de dihidrógeno y de 1 L de dinitrógeno. ¿Qué volumen de amoniaco puedes obtener? (Recuerda ajustar la ecuación, y ten presente que todos los volúmenes están medidos en las mismas condiciones de presión y temperatura).
Si las sustancias que intervienen en la reacción no son todas gaseosas, debes utilizar la ecuación de estado de los gases ( p.V = n·R·T) para obtener el factor que en la secuencia de operaciones relacione el volumen del gas y la cantidad de sustancia:
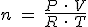
Cuando las condiciones de presión y temperatura son las normales(c.n.), 273 K (0ºC) y 1 atm, puedes tener en cuenta que un mol de cualquier gas ocupa 22,4 L.
 |
|
Imagen 16. Rafti Institute, |
NH4NO3 → N2O + H2O
¿Qué volumen de monóxido de dinitrógeno (gas de la risa), medido en condiciones normales, se formará si se descomponen 15 g de nitrato de amonio?
Masas atómicas relativas: N = 14 ; O = 16 ; H = 1
 |
|
Imagen 17. Isftic, uso educativo |
Si el rendimiento de la reacción es del 60 %, ¿qué volumen de dióxido de carbono se formará, medido a 740 mm Hg de presión y 25ºC de temperatura?
Constante de los gases R = 0,082 atm · L / K · mol
760 mm Hg = 1 atm
¿Cuántos
moles de dioxígeno gaseoso se necesitan para reaccionar con 44,8 litros de gas
dihidrógeno para producir H2O(g)? Considera que todos los volúmenes están medidos en condiciones normales.
 |
| Imagen 18. U.S.Departament of justice, dominio público |
¿Cuántos litros de oxígeno, medidos en condiciones normales de presión y temperatura, se necesitan para quemar 15 litros de gasolina (supuesto que es C7H16) de densidad 0,68 kg/L?
Si el rendimiento de la combustión es del 85 %, ¿qué volumen de dióxido de carbono se obtendrá, medido en condiciones normales de presión y temperatura?