1. Reacciones según la transformación que se produce
Son reacciones químicas en las que dos o más sustancias (reactivos) se combinan para formar otra distinta (producto) más compleja.
Si los reactivos son elementos se llaman reacciones de formación.
|
|
| Video 1. Sciencevidds. YouTube |
La ecuación química general es:
A + B → AB
Ejemplos:
Fe + S → FeS
4 Al + 3 O2 → 2 Al2O3
CaO + H2O → Ca(OH)2
SO3 + H2O → H2SO4
En el vídeo adjunto puedes observar la reacción de formación del cloruro de sodio:
2 Na + Cl2 → 2 NaCl
El vídeo está subtitulado en
inglés y es de fácil comprensión.
Reacciones de descomposición
Son reacciones químicas en las que un compuesto se descompone en dos o más sustancias más simples. Son las inversas de las reacciones de síntesis.
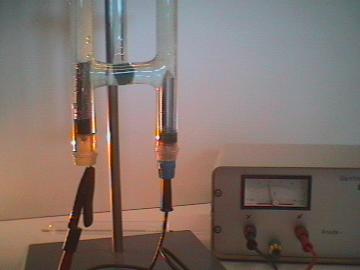 |
| Imagen 1. Grimlock. Dominio público |
La ecuación química general es:
AB → A + B
Ejemplos:
CaCO3 → CaO + CO2
2 H2O → 2 H2 + O2
2 AlCl3 → 2 Al + 3 Cl2
2 KClO3 → 2 KCl + 3 O2
Las reacciones de sustitución o desplazamiento pueden ser simples o dobles.
En una reacción de sustitución o desplazamiento simple, un elemento es reemplazado por otro elemento más reactivo en un compuesto, para producir un nuevo compuesto y el elemento desplazado.
|
|
| Vídeo 2. Nuclearrabbit. YouTube |
La ecuación química general es:
A + BC → AC + B
Ejemplos:
2 Al + 3 CuSO4 → Al2(SO4)3 + 3 Cu
Fe2O3 + 2 Al → Al2O3 + 2 Fe
2 Na + 2 H2O → 2 NaOH + H2
2 Al + 6 HCl → 2 AlCl3 + 3 H2
En el vídeo adjunto se vierte disolución de AgNO3 sobre un hilo de cobre. Cuando se pone en contacto el AgNO3 con el cobre, observas que el hilo cambia de color y se hace más grueso. Al acercar la imagen ves los cristalitos de plata. Al cabo de un tiempo, la disolución se vuelve azul. Al agitar el hilo la plata se desprende. Se ha producido la reacción:
Cu + AgNO3 → Cu(NO3)2 + Ag
En una reacción de doble sustitución o desplazamiento hay
dos compuestos químicos que intercambian dos elementos para formar dos nuevos
compuestos.
La ecuación química general es:
AB + CD → AD + CB
Las reacciones de doble
desplazamiento se producen generalmente en disolución acuosa con compuestos
iónicos, y en ellas se produce un precipitado (sólido), se forma un gas o se
produce agua.
Ejemplos:
KCl + AgNO3 → KNO3 + AgCl↓ (AgCl, precipitado)
LiH + H2O → LiOH + H2↑ ( H2, gas)
HCl + NaOH → NaCl + H2O (H2O, agua)
AlCl3 + 3 NH4OH → 3 NH4Cl + Al(OH)3↓ (Al (OH)3, precipitado)
Indica el tipo de reacción química al que pertenecen las representadas en las ecuaciones químicas siguientes, atendiendo al criterio de la transformación que se produce:
a) 2 HgO → 2 Hg + O2↑
b) 2 H2 + O2 → 2 H2O
c) Zn + 2 HCl → ZnCl2 + H2↑
d) 2 KI + Pb(NO3)2 → 2 KNO3 + PbI2 ↓
 |
| Imagen 2. Elaboración propia |
Un clavo de hierro se introduce en una disolución de sulfato de cobre(II). Se observa que la disolución se decolora y se forma un precipitado de cobre. La ecuación química que representa esta reacción es: Fe + CuSO4 → FeSO4 + Cu
Verdadero Falso