2.4 Interpretación macroscópica

|
| Imagen 8. Banco imágenes ISFTIC, uso educativo |
Observa que ya tienes la proporción entre masas que necesitabas. Estas masas están expresadas en unidades de masa atómica (u), pero como la ley de las proporciones constantes indica que estas proporciones deben ser siempre las mismas, tendrán que verificarse independientemente de las unidades en las que la masa se exprese. Por ello es posible afirmar que siempre que el hidrógeno y el oxígeno reaccionen para producir agua, lo harán en la siguiente proporción:
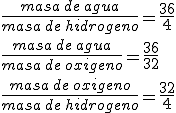
Esto ocurrirá así independientemente de la unidad de masa que utilices (u, kg, pero normalmente gramos) y te permitirá realizar cálculos con las masas de las sustancias que intervienen en una reacción química.
2·NA moléculas de H2 + 1·NA moléculas de O2 → 2·NA moléculas de H2O
ó lo que es lo mismo:
2 moles de H2 + 1 mol de O2 → 2 moles de H2O
dando lugar a la relación macroscópica entre cantidades de sustancia de reactivos y de productos.
Observa la reacción anterior y fíjate en que aunque en las reacciones químicas se conserva la masa, no lo hace el número de partículas ni la cantidad de sustancia.
Recuerda la historia inicial. Uno de los métodos de producción del aluminio que menos energía precisa es el empleado por la empresa Alcoa, en el que se utiliza un proceso cerrado que mejora el rendimiento de los procesos tradicionales.
En él, las reacciones químicas que tienen lugar son las siguientes:
Al2O3 + C + Cl2 → AlCl3 + CO2
AlCl3 ![]() Al + Cl2
Al + Cl2
Ajusta las ecuaciones químicas e interprétalas a escala macroscópica.