2.2 Ajuste de ecuaciones químicas
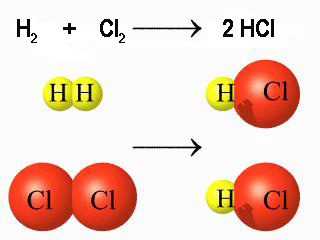 |
| Imagen 5. Elaboración propia |
El número de átomos de cada tipo permanece constante en una reacción química, ya que como se ha indicado un cambio químico consiste en una reordenación de los átomos, con ruptura de enlaces y formación de otros nuevos, pero sin crear ni destruir átomos en el proceso (en tal caso se hablaría de una reacción nuclear).
Al escribir una ecuación química, suele ocurrir que no hay el mismo número de átomos de cada tipo en cada lado de la ecuación (ya que debe verificarse la ley de conservación de la masa), por lo que es necesario realizar un proceso de ajuste. Dado que si cambiamos su fórmula cambiamos de sustancia, no será posible cambiar los subíndices de los compuestos participantes, sino que deberemos "jugar" con el número de partículas de cada tipo que intervienen, hasta lograr que la reacción esté ajustada. Es decir, deberemos ajustar los coeficientes estequiométricos. A la hora de ajustar, siempre se intentará que los coeficientes estequiométricos sean enteros y lo menores posibles, es decir, que no tengan divisores comunes.
El proceso que debes seguir para ajustar una ecuación química es el siguiente:
- Escribe la reacción en la forma : Reactivos → Productos.
- Observa los átomos de cada tipo que hay a cada lado de la reacción.
- Si hay algún tipo de átomo que no está compensado, añade el coeficiente estequiométrico correspondiente para que el número se iguale. En caso que haya más de un tipo, comienza por el que pertenezca a la partícula más compleja.
- Comprueba si la inclusión de este coeficiente ha descompensado algún otro tipo de átomo, y repite el proceso hasta que consigas que el número de átomos de cada tipo sea el mismo a ambos lados.
Ajusta las siguientes ecuaciones químicas:
NOTA: Normalmente cuando el coeficiente estequiométrico es la unidad se omite y no se indica. Sin embargo, en esta actividad deberás indicarlo.
Mg + O2 → MgO
Cl2 + KBr → KCl + Br2
Fe2O3 + C → Fe + CO2
C4H10 + O2 → H2O + CO2